Pressmeddelande: Nobelpriset i fysiologi eller medicin 2002
English
French
German
Swedish

7 oktober 2002
Nobelförsamlingen vid Karolinska Institutet har idag beslutat att
Nobelpriset i Fysiologi eller Medicin år 2002 gemensamt tilldelas
Sydney Brenner, H. Robert Horvitz och John E. Sulston
för deras upptäckter rörande “genetisk reglering av organutveckling och programmerad celldöd”
Sammanfattning
I vår kropp finns hundratals olika celltyper och alla härstammar från den befruktade äggcellen. Under fosterutvecklingen sker en mycket omfattande ökning av antalet celler, som mognar och specialiseras för att bilda kroppens olika vävnader och organ. Även i den vuxna individen nybildas dagligen stora mängder celler. Parallellt med denna celltillväxt förekommer, både hos foster och vuxna, celldöd som en normal process för att rätt antal celler i vävnaderna ska upprätthållas. Denna finstämda, kontrollerade eliminering av celler kallas programmerad celldöd.
Årets tre Nobelpristagare i Fysiologi eller Medicin har gjort avgörande upptäckter av hur organutveckling och programmerad celldöd regleras genetiskt. Genom att etablera och använda rundmasken Caenorhabditis elegans som modellsystem lyckades man exakt följa celldelningar och specialiseringar från befruktad äggcell till vuxen individ. Pristagarna har identifierat nyckelgener som reglerar organutveckling och programmerad celldöd och visat att motsvarande gener finns hos högre organismer, inklusive människa. Upptäckterna har haft stor betydelse för den medicinska forskningen och ökat förståelsen för hur en rad sjukdomar uppkommer.
Sydney Brenner (f 1927), Berkeley, CA, USA, etablerade C. elegans som en ny modellorganism. Detta skapade en unik möjlighet att koppla genetisk analys till celldelning, cellmognad och organutveckling – och att samtidigt kunna följa dessa processer i mikroskop. Brenners upptäckter, som gjordes i Cambridge, England, lade grunden till årets pris.
John Sulston (f 1942), Cambridge, England, kartlade ett “cellsläktträd”, där varje celldelning och cellmognad kunde följas under utvecklingen av en vävnad i C. elegans. Han visade att bestämda celler genomgår programmerad celldöd som en del av den normala utvecklingen och identifierade den första mutationen i en gen som deltar i celldödsprocessen.
Robert Horvitz (f 1947), Cambridge, MA, USA, har upptäckt och karaktäriserat de nyckelgener som styr den programmerade celldöden i C. elegans. Han har visat hur dessa gener samverkar med varandra i cellens dödsprocess och att motsvarande gener finns hos människa.
Cellernas släktträd – från ägg till vuxen individ
Alla celler i vår kropp är ättlingar till den befruktade äggcellen. Man kan därför tala om ett “cellernas släktträd”. Cellerna mognar och specialiseras för att bilda olika vävnader och organ, t ex muskler, blod, hjärta och nervsystem. Hos människa finns flera hundra typer av celler och samarbetet mellan olika specialiserade celler gör att kroppen kan fungera som en helhet. För att upprätthålla lämpligt antal celler i vävnaderna krävs en finstämd balans mellan celldelning och celldöd. Cellerna måste mogna på ett korrekt sätt och vid rätt tidpunkt under utvecklingen för att rätt sorts specialiserade celler ska bildas.
Att förstå hur dessa komplicerade processer styrs har stort biologiskt och medicinskt värde. I encelliga modellorganismer, t ex bakterier och jästceller, kan man inte studera organutveckling och samspel mellan olika celler. Däggdjur är å andra sidan alltför komplexa för sådana grundläggande studier, eftersom de består av ett så stort antal celler. Rundmasken C. elegans, med sin flercellighet men relativa enkelhet, blev därför det modellsystem som möjliggjorde sådana studier och som sedan ledde till att dessa processer också kunde utforskas hos människa.
Programmerad celldöd
Liv förutsätter att celler delar sig och ger upphov till nya celler, men också att celler dör, så att balansen kan bibehållas inom våra organ. Hos en vuxen människa nybildas varje dygn mer än tusen miljarder celler. Samtidigt dör ungefär lika många celler genom en kontrollerad “självmordsprocess” som kallas programmerad celldöd.
Denna programmerade celldöd uppmärksammades först av utvecklingsbiologerna. De noterade att celldöd var nödvändig för embryonalutvecklingen, exempelvis när svansförande yngel förvandlas till fullvuxna grodor. Under den mänskliga fosterutvecklingen avlägsnas genom programmerad celldöd den simhud som ursprungligen anläggs mellan fingrar och tår. Samma mekanism gör att det stora överskott av nervceller som bildas under hjärnans utveckling elimineras.
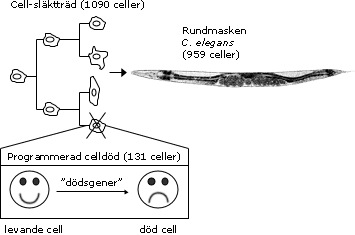
Det stora genombrottet för förståelsen av programmerad celldöd skedde när årets Nobelpristagare upptäckte att specifika gener styr cellens dödsprogram i rundmasken C. elegans. Detaljerade studier av denna enkla organism visade att det under utvecklingen alltid dör exakt 131 av de totalt 1090 cellerna och att denna naturliga celldöd regleras av en unik uppsättning gener.
Modellorganismen C. elegans
Sydney Brenner insåg redan i början av 1960-talet att fundamentala frågor kring cellmognad och organutveckling var svåra att studera i högre djur. Det krävdes en organism som var flercellig men samtidigt cellulärt enklare och lämplig för genetiska studier. En nematod, rundmasken Caenorhabditis elegans, visade sig vara den idealiska lösningen. Masken, som är cirka en millimeter lång, har kort generationstid och är så genomskinlig att celldelningar kan följas direkt i mikroskopet.
Brenner lade grunden i ett arbete 1974, där han på ett banbrytande sätt visade att specifika mutationer, genförändringar, kunde framkallas i C. elegans arvsmassa genom tillförsel av det kemiska ämnet EMS (etylmetansulfonat). Olika mutationer kunde kopplas till specifika gener och till specifika effekter på organutvecklingen. Denna kombination av genetisk analys och av i mikroskopet direkt iakttagbara celldelningar ledde till de upptäckter som belönas med årets Nobelpris.
Kartläggning av cellernas släktträd
John Sulston byggde vidare på Brenners arbete med C. elegans och utvecklade tekniker för att studera varje celldelning i rundmasken, från den befruktade äggcellen till de 959 cellerna i den vuxna organismen. I ett arbete 1976 beskrev Sulston ett cellsläktträd för en del av nervsystemets utveckling. Han påvisade att släktträdet var exakt, dvs att varje individ av C. elegans genomgick precis samma program för celldelning och cellmognad.
Som ett resultat av dessa fynd gjorde Sulston den viktiga upptäckten att vissa bestämda celler alltid dog genom programmerad celldöd och att detta kunde observeras i den levande organismen. Han kartlade de olika stegen i cellens dödsprocess och kunde påvisa de första mutationerna i gener som deltar i programmerad celldöd, däribland nuc-1-genen. Sulston visade också att det protein som nuc-1-genen ger upphov till har uppgiften att bryta ned den döda cellens arvsmassa, DNA.
“Dödsgener” identifierade
Robert Horvitz utvecklade Brenners och Sulstons arbete med C. elegans genetik och dess cellsläktträd. I en serie eleganta experiment, som tog sin början under 1970-talet, utnyttjade Horvitz modellsystemet för att utröna om det fanns ett genetiskt program för den programmerade celldöden. I ett nyckelarbete 1986 identifierade han de två första egentliga “dödsgenerna”, ced-3 och ced-4. Han fann att fungerande
ced-3- och ced-4-gener krävs för att celldöd ska äga rum.
Senare kunde Horvitz visa att en annan gen, ced-9, skyddar mot celldöd genom att samverka med ced-4 och ced-3. Han kunde också identifiera en rad gener som styr hur den döda cellen elimineras. Horvitz visade att även den mänskliga arvsmassan innehåller en ced-3-liknande gen. Numera vet man att de flesta gener som är inblandade i programmerad celldöd hos C. elegans har motsvarigheter hos människan.
Viktigt för många forskningsfält
Arbetet med att utveckla C. elegans som ett nytt experimentellt modellsystem, kartläggningen av dess exakta cellsläktträd och möjligheten att koppla detta till genetisk analys har visat sig oerhört värdefullt för många forskningsfält. Det gäller t ex inom utvecklingsbiologin och när man försöker förstå hur olika signalvägar fungerar i en flercellig organism. Kartläggningen av de gener som reglerar programmerad celldöd hos C. elegans ledde snabbt till identifiering av liknande gener med motsvarande funktion hos människa. Det står nu klart att en av de signaleringsvägar som leder till celldöd i våra organ har bevarats under miljoner års evolution. I denna signaleringsväg deltar såväl ced-3, ced-4 som ced-9-liknande molekyler. Störningar i denna och andra signaleringsvägar för celldöd tilldrar sig stort medicinskt intresse och förknippas med flera olika sjukdomar.
Sjukdomar och programmerad celldöd
Forskningen om programmerad celldöd har bl a hjälpt oss att förstå de mekanismer som vissa virus och bakterier använder sig av för att angripa våra celler. Man vet också att det vid exempelvis AIDS, neurodegenerativa sjukdomar, stroke och hjärtinfarkt sker en förlust av celler till följd av för mycket celldöd. Andra sjukdomar, t ex vissa autoimmuna tillstånd och cancer, kännetecknas av för lite celldöd och därmed överlevnad av celler som normalt skulle ha dött.
Inte minst inom cancerområdet är forskningen om programmerad celldöd intensiv. Många nuvarande behandlingsmetoder verkar genom att stimulera cellers “självmordsprogram”. I framtiden hoppas man att på ett mer förfinat sätt kunna framkalla celldöd i cancerceller.
 |
|
Årets Nobelpristagare har med rundmasken (nematoden) C. elegans som modellsystem visat hur organutveckling och programmerad celldöd regleras genetiskt. De har identifierat nyckelgener som reglerar programmerad celldöd och visat att motsvarande gener även finns hos högre organismer, inklusive människa. Figuren illustrerar schematiskt cellernas släktträd (överst t v) och programmerad celldöd (nedtill) i C. elegans. Den befruktade äggcellen genomgår en serie celldelningar som innebär att celler mognar och utvecklas till specifika celltyper, så att slutligen den vuxna organismen (överst t h) bildas. Hos C. elegans är alla celldelningar och specialiseringar identiska från individ till individ, och därmed kunde ett släktträd för alla celldelningar upprättas. Under rundmaskens utveckling bildas 1090 celler, varav exakt 131 celler elimineras genom programmerad celldöd. Därför har den vuxna rundmasken (hermafroditen) 959 kroppsceller. |
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 14 laureates' work and discoveries range from quantum tunnelling to promoting democratic rights.
See them all presented here.
