Communiqué de presse: Le Prix Nobel de Chimie de 1999
English
French
German
Swedish

12 Octobre 1999
L’Académie Royale des Sciences de Suède a attribué le Prix Nobel de Chimie de l’année 1999 au
Professeur Ahmed H. Zewail, California Institute of Technology, Pasadena, États-Unis
pour avoir montré qu’il est possible, grâce à une technique laser ultrarapide, d’observer le mouvement des atomes d’une molécule au cours des réactions chimiques.
Motivation de l’Académie des Sciences:
Pour ses études des stades transitoires des réactions chimiques par spectroscopie ultrarapide de l’ordre des femtosecondes.
Le lauréat du Prix Nobel de Chimie est récompensé pour ses observations des réactions chimiques fondamentales, réalisées grâce à des éclairs laser ultrabrefs, avec une résolution temporelle correspondant à l’échelle de durée réelle des réactions. Les travaux de Zewail ont contribué à révolutionner la chimie et ses disciplines voisines, puisque cette approche qui permet de comprendre et de prédire des réactions à une portée considérable.
Le développement de la femtochimie est récompensé
Que serait un match de football sans les prises de vue au ralenti qui révèlent les mouvements des joueurs et du ballon lors du marquage d’un but? Cette question est également applicable aux réactions chimiques. La curiosité des chimistes qui les poussent à vouloir suivre directement les processus réactionnels dans le moindre détail a stimulé le développement de techniques toujours plus avancées. Ahmed H. Zewail, le lauréat du Prix Nobel de Chimie de l’année, a étudié l’évolution au ralenti des atomes et des molécules au cours d’une réaction et observé les phénomènes survenant lors de la rupture des liaisons chimiques, puis lors de leurs nouvelles combinaisons.
Zewail a exploité une technique qui peut être décrite comme l’appareil photo le plus rapide au monde. La technique consiste à émettre des éclairs laser si brefs que le chercheur peut suivre les processus réactionnels à l’échelle de durée où ils ont réellement lieu, notamment de l’ordre des femtosecondes (fs), Une femtoseconde est égale à 10-15 secondes, soit à 0, 000000000000001 seconde. Cette unité est aussi petite par rapport à la seconde qu’une seconde par rapport à 32 millions d’années. Cette branche de la chimie physicaliste a été baptisée femtochimie.
La femtochimie permet de comprendre pourquoi certaines réactions chimiques ont lieu mais pas d’autres. Elle nous aide aussi à comprendre pourquoi la vitesse des réactions et leurs effets sont liés à la température. Grâce à la spectroscopie ultrarapide, des chercheurs du monde entier peuvent étudier les processus dans des gaz, des liquides, des solides, ainsi que sur des surfaces et dans des polymères. Les applications s’étendent du fonctionnement des catalyseurs, en passant par la construction des composants électroniques moléculaires, jusqu’aux mécanismes les plus fins des processus de la vie et au développement des produits pharmaceutiques de demain.
Quelle est la rapidité des réactions chimiques?
Ainsi que chacun sait, les réactions chimiques peuvent se dérouler à des vitesses très différentes – comparons la flamme d’une bougie à l’explosion de la dynamite! La plupart des réactions sont cependant gouvernées par des lois communes: leur rapidité augmente en fonction de la température, c’est-à-dire quand le mouvement des molécules s’intensifie.
C’est pourquoi les chercheurs croyaient depuis longtemps qu’une molécule devait être préalablement excitée, catapultée au-delà d’une certaine barrière pour déclencher une réaction. Quand deux molécules entrent en collision, il ne se passe généralement rien, elles se repoussent uniquement. Mais, quand la température est suffisamment élevée, la collision devient si intense qu’elles interagissent pour constituer de nouvelles molécules. Quand une molécule subit une excitation énergétique suffisamment forte, elle réagit de façon extrêmement rapide ce qui entraîne la rupture de certaines liaisons et la formation de nouvelles. Cette loi régit également les processus réactionnels apparemment lents (telle la rouillure d’un clou). La différence étant que les pointes de température surviennent plus rarement pour une réaction lente que pour une plus rapide.
La barrière est déterminée par les forces qui retiennent les atomes entre eux dans la molécule (les liaisons chimiques). On peut la comparer au mur que constitue la force de gravitation que doit vaincre une fusée lancée de la terre avant d’entrer sous l’influence du champ gravitation lunaire. Mais jusqu’à une époque très récente, on ne savait pas grand-chose du stade de transition, c’est-à-dire de l’évolution de la molécule vers la barrière et ses caractéristiques au moment où elle la franchit.
Cent ans de recherche
Svante Arrhenius (Prix Nobel de Chimie 1903), inspiré par van’t Hoff (premier Prix Nobel de Chimie en 1901), proposa, il y a un peu plus d’un siècle, une formule simple décrivant la vitesse de réaction comme fonction de la température. Mais celle-ci était applicable à des populations de molécules (des systèmes macroscopiques) et à des durées relativement longues. Ce n’est que dans les années 1930 que H. Eyring et M. Polanyi présentèrent une théorie basée sur des réactions dans des systèmes microscopiques constitués de molécules individuelles. La théorie posait l’hypothèse d’un franchissement très rapide du stade transitoire, d’un ordre de durée équivalent aux vibrations moléculaires. On ne pouvait alors pas imaginer qu’il serait un jour possible de réaliser des expériences sur des durées aussi courtes.
Mais c’est justement dans ce domaine que ce que Zewail a concentré ses recherches. A la fin des années 1980, il a dirigé une série d’expériences qui allaient poser les bases d’une nouvelle discipline scientifique appelée femtochimie. Le principe consistait à prendre des clichés des molécules pendant le processus réactionnel à l’aide d’un appareil ultrarapide, puis à tenter d’obtenir un film des séquences juste au moment du stade transitoire. La construction de l’appareil photo exploitait une technique laser récemment mise au point pouvant tirer des éclairs laser de quelque dizaines de femtosecondes. La durée nécessaire à des atomes moléculaires pour effectuer une vibration est, dans ce cas précis, de 10 à 100 fs. On peut effectuer une comparaison afin d’illustrer pourquoi les chercheurs supposaient que la durée des réactions chimiques devait coïncider à l’échelle de durée des oscillations des atomes dans la molécule: deux trapézistes «interagissent» selon une même échelle de durée que celle du balancement de leurs trapèzes.
Quelles observations les chercheurs ont-ils pu faire grâce à l’amélioration successive de la résolution temporelle? Les premiers progrès furent la découverte de corps – appelés intermédiaires – constitués lors de la transition entre les molécules initiales et les produits de la réaction. Au début, les expériences étaient le plus souvent réalisées sur des molécules ou bien des fragments moléculaires relativement stables. Chaque amélioration de la résolution temporelle permettait de constituer de nouveaux maillons, sous forme d’intermédiaires de longévité toujours plus courte, dans les séquences réactionnelles progressivement reconstituées pour comprendre le mécanisme de réaction.
La contribution pour laquelle Zewail reçoit le Prix Nobel indique que nous sommes arrivés à destination: aucune réaction chimique n’est plus rapide. Grâce à la spectroscopie ultrarapide, il nous est possible, pour la première fois, d’observer au ralenti les phénomènes en présence, au passage de la barrière de réaction. Ainsi nous pouvons comprendre l’arrière-plan mécanique de la formule d’Arrhenius pour la dépendance de la température, tout comme les formules pour lesquelles van’t Hoff reçut le Prix Nobel.
La femtochimie en pratique
Pour réaliser une spectroscopie ultrarapide, Zewail mélange les substances initiales sous forme de faisceaux moléculaires dans une chambre à vide. Ensuite, il laisse un rayon laser ultrarapide émettre deux impulsions. La première, puissante, appelée impulsion d’excitation, atteint la molécule et l’excite à un plus haut niveau d’énergie; la seconde plus faible, appelée impulsion de sondage, a une longueur d’onde réglée pour détecter la molécule initiale ou la nouvelle formation. L’impulsion d’excitation est le signal de départ de la réaction alors que l’impulsion de sondage examine son résultat. En faisant varier l’intervalle temporel entre les deux impulsions, on peut observer la vitesse de transformation de la molécule initiale. Les nouvelles formes que prend la molécule quand elle est excitée – elle passe peut-être par un ou plusieurs stades transitoires – présente un spectre qui constitue une empreinte digitale. L’intervalle temporel entre les impulsions d’excitation et de sondage est facilement modifiable: il suffit de détourner la trajectoire de l’impulsion de sondage en la réfléchissant sur des miroirs. Mais ce ne sont que des détours marginaux: la lumière parcoure 0,03 mm en 100 fs!
Afin de mieux comprendre les phénomènes, les chimistes comparent l’empreinte digitale obtenue et la durée du processus à des simulations théoriques basées sur les résultats de calculs chimio-quantiques (Prix Nobel de Chimie 1998) des spectres et des énergies des molécules dans leurs différents états.
Les premières expériences
Dans ses premières expériences, Zewail étudia la dissociation de l’iodo-cyanide:
ICN –> I + CN. Son équipe réussit à observer un stade transitoire juste au moment où la liaison I-C allait disparaître; la durée totale de réaction est de 200 femtosecondes.
Dans une autre expérience majeure, Zewail étudia la dissociation de l’iodide de sodium (NaI): NaI –> Na + I. L’impulsion d’excitation agit sur la paire d’ions Na+ I –, qui garde une distance d’équilibre de 2,8 Å entre les noyaux atomiques (Figure 1), et génère une forme excitée [NaI]* qui présente alors une liaison covalente. Cependant, les propriétés changent quand la molécule vibre: quand les atomes sont dans leur position externe de retour, espacés de 10 à 15 Å, la structure électronique est ionique, alors qu’elle est covalente pour des distances inférieures. A un point donné du cycle de vibration, juste au moment où des atomes sont distants de 6,9 Å, la probabilité est grande pour que la molécule, soit reprenne son état initial d’équilibre, soit se décompose en atomes de sodium et d’iode.
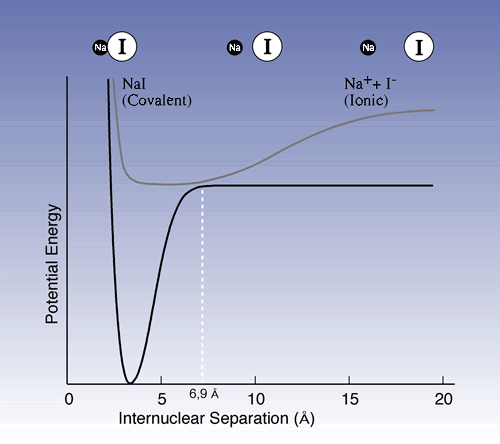 |
| Figure 1. Courbes de potentiel énergétique qui montrent l’état initial et l’état excité pour NaI. La courbe supérieure représente les vibrations des molécules dans NaI excité. Quand la distance entre le noyau de sodium et le noyau d’iode est courte, la liaison covalente est plus fréquente, alors que la liaison ionique est plus probable pour les distances plus longues. Les vibrations peuvent être comparées à une boule qui évolue en mouvement de va-et-vient dans un bol. Au passage du point 6,9 Å, il y a une chance pour que la boule retombe vers la courbe inférieure. Elle peut alors tomber dans le trou à gauche (retour vers l’état d’équilibre initial) ou bien évoluer vers la droite (se dissocier en atomes ioniques de sodium et d’iode). |
Zewail étudia également la réaction entre l’hydrogène et le dioxyde de carbone:
H + CO2 –> CO + OH une réaction qui a lieu dans l’atmosphère et au cours de la combustion. Il montra que la réaction passe par un stade relativement prolongé HOCO (1000 fs).
Des nombreux chercheurs se sont intéressés à la question de savoir pourquoi certaines liaisons chimiques sont plus enclines aux réactions que d’autres et ce qui se passe quand on a deux liaisons semblables dans une molécule. Se dissocient-elles simultanément ou successivement? Pour répondre à ce type de question, Zewail et son équipe ont étudié la dissociation de la molécule tétrafluordiiodométhane (C2I2F4) en tétrafluorétylène (C2F4) et en deux atomes d’iode (I):
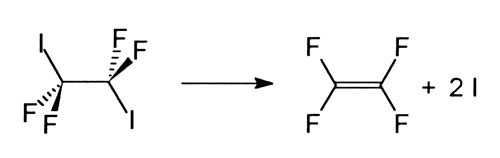
Ils observèrent que les deux liaisons C-I, bien qu’elles soient identiques dans la molécule initiale, se dissocient successivement.
La recherche est toujours plus passionnante quand les résultats sont inattendus. Zewail étudia la réaction, simple en apparence, entre le benzène, un anneau de six atomes de carbone (C6H6), et l’iode (I2). Quand les deux molécules sont suffisamment rapprochées elles forment un complexe. L’éclair laser provoque le lancement d’un électron du benzène dans la molécule d’iode qui se charge négativement alors que le benzène prend une charge positive. Les charges négatives et positives provoquent une attraction entre le benzène et l’atome d’iode le plus proche. La liaison entre les deux atomes d’iode s’étire lorsque l’un d’entre eux est absorbé vers le benzène; l’autre atome se libère et s’éloigne. Tout ce processus ne dure que 750 fs. Zewail découvrit cependant que ce cas de figure ne constitue pas le seul modèle de formation d’atomes d’iodes isolés: il arrive parfois qu’un électron retombe sur le benzène. Mais alors, il est déjà trop tard pour l’atome d’iode: telle un ruban élastique tendu qui casse, la liaison entre les deux atomes se rompt et ils sont catapultés chacun de son côté.
Explosion de la recherche
Un modèle de réaction qui très étudié en chimie organique est l’ouverture de l’anneau du cyclobutane pour obtenir de l’éthylène; ou la réaction inverse, soit deux molécules d’éthylène qui s’associent pour former du cyclobutane. On peut imaginer que la réaction passe directement par un stade transitoire, que la molécule franchit une simple barrière d’excitation ainsi que l’illustre le schéma de gauche de la Figure 2. Elle pourrait aussi suivre des séquences en deux étapes (schéma de droite): une première liaison se rompt puis un intermédiaire se constitue, le tétraméthylène. Celui-ci se transforme à son tour après avoir franchi une autre barrière d’excitation pour donner le produit final. Zewail et son équipe purent à l’aide de la spectroscopie ultrarapide montrer que la formation de l’intermédiaire avait réellement lieu et qu’il avait une longévité de 700 fs.
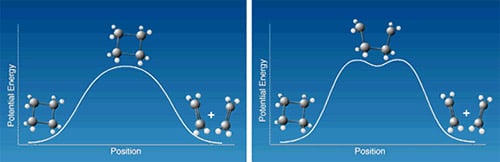 |
| Figure 2. Quels est le processus réactionnel de la molécule de cyclobutane lorsqu’elle se transforme en molécules d’éthylène? La figure de gauche montre les variations de l’énergie quand les deux liaisons s’étirent et se rompent simultanément. La figure de droite illustre le cas où les liaisons se rompent successivement. |
Un autre type de réaction a été étudié à l’aide de la technique ultrarapide: la transformation par induction lumineuse de la structure d’une molécule, phénomène appelé photo-isomérisation. Zewail et son équipe ont observé la dynamique de la molécule stilbène (composée de deux anneaux de benzène) entre les formes cis et trans.
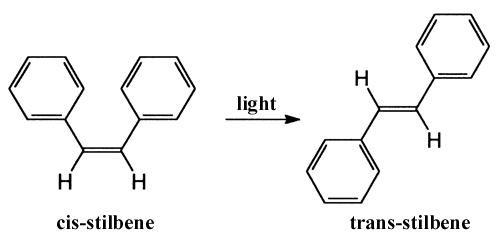
Ils conclurent que les deux anneaux de benzène se vrillent synchroniquement l’un par rapport à l’autre. Récemment, des chercheurs ont observé un phénomène similaire pour la molécule rétinal qui est un colorant de la rodopsine, le pigment de nos yeux permettant la détection de la lumière. Le stade primaire photochimique, alors que nous détectons une source lumineuse, est une transformation cis–trans autour d’une double liaison dans le rétinal. Grâce à la spectroscopie ultrrapide, d’autres équipes de chercheurs ont constaté que le processus dure 200 fs et qu’une certaine vibration est conservée dans le produit de la réaction. La vitesse de réaction indique que l’énergie du photon absorbé n’est pas initialement distribuée mais localisée directement à la double liaison actuelle. Ceci pourrait expliquer l’efficacité de l’effet (70%) de la transformation et ainsi notre bonne vision dans l’obscurité.
La femtochimie explique également pour un autre exemple biologique l’efficacité de la transformation énergétique: les molécules de chlorophylle qui captent la lumière dans la photosynthèse.
Les études de l’ordre des femtosecondes telles celles auxquelles Zewails’est consacré, sont intensément conduites dans le monde entier, non seulement sur des faisceaux moléculaires mais aussi sur des surfaces (p. ex. pour comprendre et améliorer les catalyseurs), sur des liquides et des solvants (pour comprendre les mécanismes de dissolution et les réactions chimiques entre les corps d’une solution), ainsi que sur des polymères (pour développer de nouveaux matériaux électroniques, par exemple). Une connaissance approfondie des processus réactionnels permet également de maîtriser les réactions. Souvent, une réaction chimique souhaitée génère une série de réactions indésirables, concurrentielles, qui produisent un mélange de produits, et exige donc des opérations de séparation et d’épuration. S’il était possible de contrôler la réaction en limitant le processus à des liaisons sélectionnées, ces effets secondaires seraient éliminés.
La femtochimie a fondalement transformé notre conception des réactions chimiques. Décrits à l’origine par des métaphores relativement nébuleuses telles que «excitation» et «stade transitoire», les processus gouvernant les mouvements des atomes pris individuellement, tels que nous pouvons les imaginer, se laissent désormais observer. Ils ne sont plus invisibles. C’est la raison pour laquelle la recherche dans le domaine de la femtochimie, initiée par le Prix Nobel de l’année, connaît une réelle explosion. Avec l’appareil photo le plus rapide au monde sous la main, seule l’imagination pose les limites des nouveaux domaines d’applications.
| Liste d’ouvrages conseillés |
| “Extended version in English” (pdf) by Professor Bengt Nordén. |
| M.A. El-Sayed, I. Tanaka et Y. Molin “Ultrafast Processes in Chemistry and Photobiology” Blackwell Science 1995 306 pp, ISBN 0-86542-893-X. |
| S. Pedersen, J.L. Herek et A.H. Zewail “The Validity of the Diradical Hypothesis: Direct Femtosecond Studies of the Transition-State Structures”. Science Vol 266 (1994) 1359-1364. |
| A.H. Zewail “The Birth of Molecules” Scientific American December 1990 p 40-46. |
| V.K. Jain “The World’s Fastest Camera” The World and I, October 1995 p 156-163. |
| Nobel Symposium: Femtochemistry & Femtobiology: Ultrafast Reaction Dynamics at Atomic-Scale Resolution (Editor: V. Sundström) World Scientific, Singapore 1996. |
Ahmed H. Zewail est originaire en Egypte où il a passé sa jeunesse. Il commença ses études à l’Université d’Alexandrie et les poursuivit aux Etats-Unis. Il passa son doctorat à Pennsylvania University en 1974. Après un séjour de deux ans à Berkeley University en Californie, il entra au California Institute of Technology où il est professeur titulaire d’une chaire Linus Pauling en physique chimique depuis 1990. Zewail est citoyen de l’Égypte et États-Unis.
Professor Ahmed H. Zewail
California Institute of Technology
Arthur Amos Noyes Laboratory of Chemical Physics
Mail Code 127-72
Pasadena, California 91125
USA
Le montant du prix s’élève à SEK 7,900,000.
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 12 laureates' work and discoveries range from proteins' structures and machine learning to fighting for a world free of nuclear weapons.
See them all presented here.
