Nobelvortrag
gehalten am 2 Juni 1920 in Stockholm
Hochansehnliche Versammlung!
Die schwedische Akademie der Wissenschaften hat die Darstellung des Ammoniaks aus Stickstoff und Wasserstoff der Ehrung durch Zuerkennung des Nobelpreises wert gefunden. Diese ausserordentliche Auszeichnung legt mir die Pflicht auf, die Stellung zu kennzeichnen, die die Reaktion im Rahmen des Faches einnimmt und den Weg zu schildern, der zu ihr geführt hat.
Es handelt sich um einen chemischen Vorgang der einfachsten Art. Gasförmiger Stickstoff bildet mit gasförmigem Wasserstoff nach einfachen Mengenverhältnissen gasförmiges Ammoniak. Die drei beteiligten Stoffe sind seit mehr als einem Jahrhundert dem Chemiker wohlbekannt. Jeder von ihnen ist in der zweiten Hälfte des vergangenen Jahrhunderts, in der uns ein Strom neuer chemischer Kenntnisse zufloss, hundertfältig in seinem Verhalten unter den verschiedensten Bedingungen studiert worden. Wenn es dennoch bis in unser Jahrhundert gedauert hat, ehe die Darstellung des Ammoniaks aus den Elementen gefunden wurde, so ist der Grund, dass ungewöhnliche Arbeitshilfsmittel benutzt und enge Bedingungen innegehalten werden müssen, wenn es gelingen soll, Stickstoff und Wasserstoff in erheblichem Maasse zum freiwilligen Zusammentritt zu bringen, und dass eine Verbindung experimenteller Erfolge mit thermodynamischen Überlegungen erforderlich war. Von besonderem Einfluss war, dass es früheren Bearbeitern der Frage nicht gelang, auch nur spurenweise freiwillige Vereinigung des Stickstoffs mit dem Wasserstoff zu Ammoniak mit Sicherheit nachzuweisen. Dadurch entstand das Vorurteil, dass die Darstellung unmöglich sei und gewann eine grosse Stärke in der allgemeinen Meinung des Faches. Ein solches Vorurteil lässt verborgene Hindernisse erwarten, die stärker als klar erkannte Schwierigkeiten von der Vertiefung in den Gegenstand abschrecken.
Das Interesse der näheren Fachgenossen an der Ammoniakdarstellung aus den Elementen gründet sich darauf, dass ein einfaches Resultat mit ungewohnten Hilfsmitteln erreicht worden ist. Das Interesse eines weiteren Kreises hat seine Quelle darin, dass die Ammoniak-Synthese aus den Elementen ins Grosse übertragen einen nützlichen, ja vielleicht im Augenblicke den nützlichsten Weg darstellt, um ein wichtiges volkswirtschaftliches Bedürfnis zu befriedigen. Dieser praktische Nutzen war nicht das vorgesteckte Ziel meiner Versuche. Ich war nicht im Zweifel, dass meine Laboratoriums- arbeit nicht mehr liefern konnte als eine wissenschaftliche Feststellung der Grundlagen und eine Kennzeichnung der experimentellen Hilfsmittel, und dass zu diesem Ergebnis vieles hinzukommen musste, um ein wirtschaftliches Gelingen im industriellen Maasse zu sichern. Aber ich würde auf der anderen Seite diesen Gegenstand schwerlich so eingehend studiert haben, wenn ich nicht von der volkswirtschaftlichen Notwendigkeit eines chemischen Fortschrittes auf diesem Gebiete überzeugt und von dem Fichte’schen Gedanken erfüllt gewesen wäre, dass der nächste Zweck der Wissenschaft in ihrer eigenen Entwicklung, der Endzweck aber in dem gestaltenden Einflüsse gelegen ist, den sie zu rechter Zeit auf das allgemeine Leben und die ganze menschliche Ordnung der Dinge übt.
Seit der Mitte des vorigen Jahrhunderts hat sich die Erkenntnis Bahn gebrochen, dass die Zufuhr des Stickstoffs eine Grundbedingung für die Entwicklung der Nährpflanze ist, dass aber die Pflanze den elementaren Stickstoff, der den Hauptbestandteil der Atmosphäre bildet, nicht aufzunehmen vermag, sondern den Stickstoff an Sauerstoff gebunden als Salpeterstickstoff verlangt, um ihn zu assimilieren. Für die Bindung an Sauerstoff kann die Bindung an Wasserstoff, die Ammoniakbindung eintreten, weil der Ammoniakstickstoff im Boden in Salpeterstickstoff übergeht. Im Naturzustand geht der gebundene Stickstoff dem Boden nicht verloren. Die grünen Pflanzen verwerten ihn zum Aufbau komplizierter Bestandteile, ohne ihn in elementaren Stickstoff zu verwandeln. Tier und Mensch nehmen ihn mit der Pflanze auf, und geben ihn in gebundener Form mit ihren Ausscheidungen und schliesslich mit ihrem toten Körper dem Boden wieder zurück. Fäulnis und Verbrennung zerstören Anteile von gebundenem Stickstoff, aber die Natur deckt den Verlust, indem sie auf der Bahn des Blitzes Stickstoff-Sauerstoff-Verbindungen in den hohen Schichten der Atmosphäre
entstehen lässt, die der Regen herniederwäscht. Zu dieser stickstoffbindenden Wirkung der elektrischen Entladung fügt sie als Quelle gebundenen Stickstoffs die Tätigkeit von Bakterien im Boden, die teils frei leben, teils sich an den Wurzelknöllchen mancher Pflanzen ansiedeln und freien Stickstoff in gebundenen überführen.
Die Agrarwirtschaft lässt das Gleichgewicht an gebundenem Stickstoff im wesentlichen bestehen. Mit dem Übergang zum Industriestaat aber beginnt die Verschleppung der Bodenerzeugnisse vom Wachstumsort der Nährpflanzen zu entlegenen Verbrauchsstätten, von denen der gebundene Stickstoff nicht wieder auf den Mutterboden zurückkehrt, dem er entnommen ist.
Aus dieser Verschleppung entsteht das weltwirtschaftliche Bedürfnis nach Zufuhr gebundenen Stickstoffs zum Boden. Es wird durch die nationalwirtschaftlichen Rücksichten gesteigert, die mit der dichteren Besiedelung in den Industriestaaten die Forderung entstehen lassen, den heimatlichen Acker zu gesteigerter Fruchtbarkeit zu bringen, und es wird weiter dadurch vermehrt, dass die emporwachsende Industrie für viele eigene chemische Zwecke gebundenen Stickstoff in Anspruch nimmt. Der Stickstoffbedarf kennzeichnet wie der Bedarf an Kohle den Abstand, der unsere Lebensform von der des Menschen trennt, der »selbst den Boden düngt, den er bebaut».
Der Landwirtschaft, die immer der Hauptverbraucher ist, wird mit der Stickstoffzufuhr allein nicht Genüge getan. Kali und Phosphorsäure sind ihr gleich unentbehrlich. Aber für die Befriedigung des Stickstoffbedarfes stand der Weltwirtschaft von Haus aus ein viel geringerer Reichtum natürlicher Vorräte zu Gebote. So wurde naturgemäss die Sorge um den Stickstoff die erste der grossen Klippen, die die neue Fahrstrasse gefährdeten, auf der wir uns in der Weltwirtschaft seit einigen Jahrzehnten bewegen.
Unsere Geschichtsbetrachtung, die gewohnt ist, die historischen Tatsachen aus der unveränderlichen Natur der Menschen zu verstehen, verführt uns gern, über den ungeheuren Einschnitt hinwegzusehen, den das vergangene Jahrhundert in der Geschichte der Menschheit bedeutet. Alle vorangehende Zeit deckte ihren Bedarf an Energie durch die physische Arbeit der Menschen und die Ausnutzung von Wind und Sonne, die älter sind als wir und unsere Lebensbedingungen überdauern werden. Das vorige Jahrhundert hat alle Tore zu dem Energievorrat der Kohle aufgetan und in den Industriestaaten Lebensformen eingebürgert, bei denen die physische Arbeit der Menschen nur das Relais betätigt, das den hundert fach stärkeren Strom der Kohlenenergie in die Adern des Weltwirtschaftskörpers steuert, Damit sind technische Notwendigkeiten entstanden, denen wir nur zu leicht mangels einer ausreichenden Entwicklung der Wissenschaft ohne genügende Vorsorge gegenüberstehen» Der augenblickliche Zustand der Welt, bei dem die Nachwirkung des Krieges in Zentraleuropa erdrückend auf der Wissenschaftspflege lastet, legt diese Erinnerung besonders nahe.
Das Bedürfnis nach Erschliessung neuer Stickstoffqueilen trat um die Wehde des vorigen Jahrhunderts stärk hervor. Seit seiner Mitte schöpften wir aus dem Bestand an Salpeterstickstoff, den die Natur in der chilenischen Hochgebirgswüste angesammelt hat. Dann lehrte der Vergleich des gewaltig ansteigenden Bedarfes mit dem abschätzbaren Vorrat, dass um die Mitte unseres Jahrhunderts ein Notstand grossen Stils unvermeidlich war,, wenn die Chemie keinen Ausweg fand.
Die chemische Fragestellung war nicht neu. Als man anfing, die Kohle zu destillieren, war man unter den Destillationsprodukten auf das Ammoniak gestossen, das in der Form des schwefelsauren Ammoniaks Eingang in die Landwirtschaft gefunden hatte. Noch im Jahre 1870 ein lästiges Abfallprodukt der Gasbereitung, war das Ammoniak im Jahre 1900 ein hoch gewerteter Begleiter der brennbaren Gase geworden, und die Kokerei-Industrie war in voller Arbeit, um überall ihre Öfen auf seine Nebengewinnung einzurichten. Seine Herkunft aus dem gebundenen Stickstoff der Kohle War geklärt. Die Verbesserung seiner Ausbeute, die kaum mehr als 1/5 vom Stickstoff der Kohle bei dem üblichen Verfahren ausmachte, war vielfach bearbeitet worden. Aber es war auf diesem Wege keine befriedigende Lösung zu erwarten. Bei einem Durchschnittsgehalt der Kohle von ungefähr 1 % an gebundenem Stickstoff konnte man die Kohle nicht allein um des Stickstoffs willen verarbeiten. Seine Gewinnung als Nebenprodukt aber zog der Erzeugung Grenzen, die es unmöglich machten, aus dieser Quelle den künftigen Ausfall des Salpeters zu ersetzen. Es Hess sich voraussehen,, dass der Bedarf an gebundenem Stickstoff, der beim Beginn des Jahrhunderts mit wenigen 100000 Tonnen im Jahre zu befriedigen war, in die Millionen von Tonnen hineinwachsen musste. Ein solcher Bedarf konnte nur aus einer Quelle gedeckt werden, aus dem ungeheuren Vorrat an elementarem Stickstoff, den unsere Atmosphäre darstellt, und die Bindung musste auf chemischem Wege an die einfachsten und verbreitetsten chemischen Elemente gelingen, wenn die Lösung dem Erfordernis entsprechen sollte- Wie als Ausgangsmaterial der elementare Stickstoff durch die Rohstoff-Verhältnisse unserer Erde gegeben war, so war als Endprodukt Ammoniak oder Salpetersäure durch die Bedürfnisse der Pflanze vorgeschrieben. Die Aufgabe kam also darauf hinaus, den elementaren Stickstoff an Sauerstoff oder an Wasser zu binden.
Auch in dieser Stellung war das chemische Problem nicht neu und nicht unbearbeitet. Die Vereinigung des Stickstoffs mit dem Wasserstoff zu Ammoniak wie mit dem Sauerstoff zu salpetersaueren Verbindungen hatte die Wissenschaft und zum Teil die Technik beschäftigt.
Die Vereinigung mit dem Wasserstoff unmittelbar aus den Elementen war mit verschiedenen Formen der elektrischen Entladung erzwungen worden, bei denen freilich der Energieaufwand in einem abschreckenden Verhältnis zum Ergebnis stand. Die indirekte Vereinigung hingegen war mit technisch bemerkenswertem Erfolge bearbeitet worden, indem man den Stickstoff mit anderen Elementen vereinigt und diese Vereinigung nachher mit Wasser unter Abspaltung von Ammoniak zerlegt hatte. Nur der freiwillige Zusammentritt der Elemente war unbekannt, als ich 1904 begann, mich mit dem Gegenstande zu beschäftigen, und galt für ausgeschlossen, nachdem man Druck, Wärme und die vermittelnde Wirkung des Platin- schwammes ausserstande gefunden hatte, sie hervorzubringen.
Der indirekte Weg hat die Wissenschaft und die Technik immer wieder beschäftigt, seit Marguerite und Sourdeval ihn 1860, auf Bunsens und Playfairs älteren Untersuchungen fussend, an einem Musterfall entwickelt hatten. Ätzbaryt und Kohle lieferten bei hoher Temperatur mit Stickstoff Cyanbarium. Bei erniedrigter Temperatur zerfiel diese Verbindung mit Wasserdampf unter Bildung von Ammoniak und Entstehung von Bariumhydroxyd, das wieder in den Prozess zurückkehrte. So wurde fortlaufend unter abwechselnder Bildung und Zerstörung des Cyanbariums Kohlensäure und Ammoniak aus Kohlenstoff, Wasser und elementarem Stickstoff gewonnen. In dem halben Jahrhundert, das der Veröffentlichung von Marguerite und Sourdeval folgte, ist dieser indirekte Weg, dessen erste technische Durchführung übermässige Anforderungen an die Reaktionsgefässe stellte, in vielen abgewandelten Formen erneut bearbeitet worden. Der Baryt liess sich durch feuerbeständige Oxyde anderer Metalle oder Halbmetalle ersetzen. Der Vorgang der Stickstoffbindung konnte in Teilvorgänge zerlegt werden, indem zunächst durch Reduktion das Metall, Halbmetall oder Metallcarbid hergestellt wurde, das in einer Folgereaktion den Stickstoff aufnahm. Das Ergebnis war als Lösung des Problems der Ammoniakdarstellung niemals vollständig befriedigend. Vollzog sich die Reduktion des Oxyds und die Aufnahme des Stickstoffs in einem Vorgang, so verlangte sie eine sehr hohe Temperatur. Spaltete man den Vorgangs so gelangte man zu Zwischenprodukten, die leichter mit Stickstoff in Reaktion traten. Aber das Zwischenprodukt — Metall, Halbmetall oder Carbid — forderte dann für seine eigene Erzeugung aus dem Massenvorrat der Naturprodukte erst recht die Innehaltung von Bedingungen, die einen unwirtschaftlichen Aufwand elektrischer Energie — auf elektrolytischem oder elektrothermischem Wege — nötig machten.
Dem fester gebauten Stickstoffmolekül ist die Leichtigkeit fremd, mit der sich das Folgelement im periodischen System, der Sauerstoff, teilweise aufspaltet. Dem Reichtum der Autoxydations-Erscheinungen steht dementsprechend ein vollständiger Mangel an freiwillig bei gewöhnlicher Temperatur verlaufenden Reaktionen des elementaren Stickstoffs in der unbelebten Natur gegenüber. Die schwere Spaltbarkeit des Stickstoffs brachte alle die vielen Bemühungen zum Scheitern, die der Ausbildung eines technischen Ammoniakverfahrens gewidmet wurden.
Nur an einer Stelle ist man beim Studium des indirekten Weges der Ammoniakbildung aus den Elementen imstande gewesen, die Schwierigkeiten erfolgreich zu umgehen. Franck und Caro haben durch Einwirkung des Stickstoffs auf das im Lichtbogen aus Kalk und Kohle entstehende Calciumcarbid das Calciumcyanid, den wichtigen Kalkstickstoff, erhalten. Die Spaltung des Kalkstickstoffs mit Wasser liefert Ammoniak, und diese Spaltung vollzieht sich ohne unser besonderes Zutun in der Ackererde, der der Kalkstickstoff als Düngemittel zugeführt wird. Die darin gelegene Ersparnis technischer Operationen, verbunden mit der Beschränkung der Rohstoffe auf Kalk, Kohle und Stickstoff, ist für die Einbürgerung dieses Verfahrens wichtig geworden.
Die Versuche zur Bindung des Stickstoffs an den Sauerstoff reichen noch weiter zurück als die Versuche zur Bindung an den Wasserstoff. Die Grundtatsache der Vereinigung von Stickstoff und Sauerstoff in Funken hatten schon Cavendish und Priestley beobachtet. Das erste Erzeugnis ist dabei Stickoxyd, das sich in freiwilliger Reaktion mit Sauerstoff und Wasser zu Salpetersäure umwandelt. Die Stickoxydbildung ist ein Vorgang, der unter Wärmeverbrauch verläuft und ohne Zufuhr von Energie nach thermodynamischer Überlegung erst bei den höchsten Temperaturen in merklichem Umfange freiwillig geschehen kann. Aber die bei gewöhnlicher Temperatur notwendige Energiezufuhr ist so klein, dass der Nachteil dieses Energiebedarfs überwogen wird durch den Vorteil, mit Luft und Wasser als Rohstoffen auszukommen. So würde es kein besseres und wirtschaftlicheres Verfahren geben können, um den Stickstoff zu binden, wenn ein Mechanismus zu finden wäre, der elektrische Energie ohne Verschwendung in diese Gestalt der chemischen Energie zu bringen erlaubte. Das Vorbild der Natur, die die Reaktion auf der Bahn des Blitzes hervorbringt, und Cavendishs frühe erfolgreiche Nachahmung im Funken mussten mit der glänzenden Entwicklung der Elektrotechnik in den letzten Dezennien des vergangenen Jahrhunderts diesen Weg für die Lösung des Stickstoffproblems umso stärker in den Vordergrund rücken, je weniger die Fortschritte auf dem Wege der Bindung des Stickstoffs an den Wasserstoff die Fachwelt befriedigten. Die glänzende Entwicklung, die diese Bestrebungen im Anfang unseres Jahrhunderts genommen haben, ist allgemein bekannt. Die Hauptformen der technischen Gestaltung, die sich besonders an die Namen von Birkeland und Eyde, von Schoenherr und von Pauling knüpfen, haben jahrelang im Vordergrunde des fachlichen Interesses gestanden. Technisch an einer Reihe von Stellen zu bedeutendem Umfange ausgebaut und offenbar in beachtlichem Maasse geeignet, die Energie mächtiger, gut ausnutzbarer Wasserfälle für chemische Zwecke zu verwerten, hat diese Methode der Stickstoffbildung doch den Umfang nicht erreicht, zu dem sie berufen schien. Als eine Sperre liegt vor ihrer Fortentwicklung die Erfahrung, dass mit dem Aufwände einer Kilowattstunde nicht über 16 g Stickstoff in Salpetersäure überführt werden, während eine vollkommene Umwandlung der elektrischen Energie in chemische Energie den 30- fachen Betrag ergeben muss. Die Erklärung gaben Muthmann und hofer, indem sie dartaten, dass der Hochspannungsbogen, den diese Verfahren verwenden, als ein heisskalter Raum im Sinne devilles wirkt. Die Stickoxydbildung ist durch die thermischen Verhältnisse im Bogen und in seiner Umgebung bestimmt und begrenzt. Die Festlegung des thermodyna- mischen Gleichgewichtes der Stickoxydbildung durch nernst stützte diese Anschauung. Eine Extrapolation seiner Versuchsergebnisse und der besten Zahlen für die spezifische Wärme der beteiligten Gase bis auf die Temperatur von 3 ooo1 Cels. oder 4 ooo° Cels. führte zu dem bemerkenswerten Schluss, dass mehr als das iVs-fache oder Doppelte des technischen Ausbringens für die Kilowattstunde auch dann nicht zu erreichen war, wenn alle Rückbildung von Stickoxyd auf dem Abkühlungswege unterblieb. Die Quelle der geringen Ausbeute lag darin, dass die Erhitzung einer grossen Luftmasse auf die höchsten Temperaturen nur einem kleinen Bruchteil die Umbildung in Stickoxyd thermodynamisch ermöglichte. Trotzdem dieser Rechnung aus verschiedenen Gründen keine erhebliche Genauigkeit beizumessen war, kam ihr Resultat doch der Wahrheit offenbar nahe. Durch Wärmeregeneration war eine bedeutende Energieersparnis nach praktischer Erfahrung nicht erreichbar, offenbar weil die Verschlechterung der Abschreckungswirkung, die damit verbunden war, im Gegensinne wirkte. Von der Bogen- entladung loszukommen, war nicht möglich, ohne den Boden der Arbeitsweisen zu verlassen, die dem Bedürfnis der Massenerzeugung entsprachen.
Aber es war vielleicht auch mit Bogenentladung nicht völlig ausgeschlossen, von dem Temperaturgebiet loszukommen, in dem die rasche Einstellung des thermodynamischen Gleichgewichtes jede günstigere Möglichkeit einer Umwandlung elektrischer Energie in chemische überdeckte. Der Bogen lebte ja von der ständigen Hervorbringung energiereicherer Gebilde, in der Gestalt von Gasionen durch die elektrische Energie des Elektronen- stosses, und es war nicht ohne weiteres einleuchtend, dass die nachfolgende Zerstreuung der Energie als Wärme jedes andere als das thermische Ergebnis der Stickoxydbildung ausschloss, zumal Warburg und Leithaeuser nichtthermische Oxydbildung durch stille elektrische Entladung nachgewiesen hatten.
Diese Möglichkeit besass im ersten Dezennium unseres Jahrhunderts viel Interesse und hat mich seit dem Jahre 1907 zu Untersuchungen veranlasst, die während mehrerer Jahre verfolgt wurden. Die Entwicklung der Dinge hat die Anschauungen in einem kurzen Jahrzehnt so verändert, dass es heute bereits schwerfällt, sich in die Auffassungen zurückzuversetzen, die damals herrschten; aber kennzeichnend ist, dass eine so berufene und erfahrene Beurteilerin chemisch-technischer Möglichkeiten wie die Badische Anilin- und Sodafabrik meine Bemühungen um eine bessere Ausnutzung der elektrischen Energie bei der Vereinigung von Stickstoff und Sauerstoff hoch genug bewertete, um im Jahre 1908 mit mir in Verbindung zu treten und mir durch ihre Hilfsmittel die Verfolgung des Gegenstandes zu erleichtern, während sie den Vorschlag, mich auch bei der Hochdrucksynthese des Ammoniaks zu unterstützen, mit aller Zurückhaltung aufnahm und nur zögernd genehmigte. In der Tat hing die Frage, ob der Schwerpunkt der technischen Fortarbeit auf die direkte Darstellung des Ammoniaks aus den Elementen zu legen sei, auch später noch für meine Auffassung wesentlich davon ab, ob der Aufwand von Energie bei der Bindung des Stickstoffs an den Sauerstoff sich erheblich vermindern Hess, In den technischen Fragen, in denen die Wage zwischen Erfolg und Misserfolg schwankt, hängt die Entscheidung über das Gelingen oder Scheitern meistens an massigen Unterschieden im Energie- und Materialverbrauch, und Änderungen in diesen Werten, die innerhalb einer Zehnerpotenz gelegen sind, entscheiden über den Ausgang.
Deshalb habe ich mit einer Reihe ausgezeichneter Mitarbeiter die Arbeiten über die Stickoxydbildung durch elektrische Entladung längere Zeit verfolgt. Ich habe das Druckgebiet von 12 Atmosphären bis zu 25 mm Quecksilber durchgesucht, den Bogen von der Wandung und von der Anode her gekühlt und den Zusammenhang von Energieverbrauch und Frequenz bis zu etwa 50 000 Wechseln pro Sekunde verfolgt. Es wurden Stickoxydkonzentrationen von 10 % in Luft bei vermindertem Druck erreicht, die eine Abweichung vom thermodynamischen Gleichgewicht bedeuteten. Auch konnten Ausbeuten an gebundenem Stickstoff für die aufgewandte Kilowattstunde erreicht werden, die um 10 % bis 15 % den früher erwähnten technischen Wert von 16 g überholten. Aber diese Vorteile waren an sich nicht durchschlagend und wurden zudem durch Arbeitsweisen erzielt, die für die Ubersetzung in einen grossen Masstab wenig günstig waren. So führte diese Gruppe von Untersuchungen zu einer Bestärkung der Meinung, dass die Lösung der technischen Aufgabe in der unmittelbaren Vereinigung des Stickstoffs mit dem Wasserstoff zu suchen sei.
Zu demselben Resultat leitete ein Studium der Stickoxydbildung in Druckflammen. Dass die Explosion der brennbaren Gase mit Stickstoff und Sauerstoff zu der Bildung von nitrosen Produkten führt, war seit Bünsen bekannt. Liveing und Dewar hatten die Salpetersäurebildung bei der Wasserstoffflamme unter Druck beschrieben. Es schien mir nötig, auch mit dieser Stickoxydquelle näher vertraut zu werden, bei der die Wärme als Energiequelle unter Bedingungen benutzt wird, die der Industrie besonders geläufig sind. Es lagen Vorschläge vor, die die Explosionsvor- gänge zugleich motorisch verwerten und als Quelle der Stickoxydbildung verwenden wollten. Ich habe auf diese Verknüpfung zweier ganz verschiedener Aufgaben keine Hoffnungen gesetzt. Aber die Ausnutzung der Wärme von Flammengasen schien mir mit der Gewinnung von Stickoxyden nicht unvereinbar und einer näheren Untersuchung wert. Sie ist auf die Flammen des Kohlenoxydes, des Wasserstoffs und des Acetylens erstreckt worden. Es ergab sich, dass auf 100 Moleküle der Verbrennungshauptprodukte, Kohlensäure und Wasserstoff, 3 bis 6 Moleküle Salpetersäure erhalten werden konnten. Beim Kohlenoxyd und Wasserstoff bedurfte es dazu des erhöhten Druckes. Das Kohlenoxyd war vor den wasserstoffhal- tigen Gasen im Vorteil, weil die Gegenwart des Wasserdampfes in den heissen Verbrennungsprodukten die Rückbildung des Stickoxydes in die Elemente auf dem Abkühlungswege begünstigte. Bei diesem Gas war das Molekularverhältnis des Stickoxydes zur Kohlensäure mit Luft leicht auf 3 : 100, mit einer sauerstoffreicheren Mischung auf das Doppelte zu bringen. Für die technische Ausführung erwiesen sich diese Werte aber nicht als ein ausreichender Anreiz, das Gewicht, das auf die unmittelbare Vereinigung des Stickstoffs mit dem Wasserstoff fiel, erfuhr dadurch abermals eine Verstärkung.
Der Vereinigung von Stickstoff und Wasserstoff durch stille elektrische Entladung und durch den Funken bin ich nicht nachgegangen. Es schien mir sicher, dass dieser Weg sich nicht als der zweckmässige erweisen würde. In letzter Linie entschied über jeden Weg das Verhältnis des Energieaufwandes zum Ausbringen oder anders gefasst des Kohleverbrauches zum Stickstoffgewinn, wobei ein Aufwand an Wasserkraft gleich dem äquivalenten Aufwand von Kohle zu rechnen war. Nichts aber erschien weniger hoffnungsvoll als der Gedanke, bei der erzwungenen Vereinigung von Stickstoff mit Wasserstoff mit so wenig Energie auszukommen, dass man noch den Aufwand für die Wasserstoffherstellung in Kauf nehmen konnte. Es blieb nur die Möglichkeit, die Bedingungen einer freiwilligen Ammoniakbildung aus den Elementen aufzufinden. Die positive Bildungswärme des Ammoniaks sprach für die Möglichkeit seiner Bildung ohne die Zuhilfenahme elektrischer Energie. Dagegen sprach, dass weder Deville noch Ramsay und Young aus Stickstoff und Wasserstoff in der Hitze Ammoniak erhalten hatten. Ramsay und Young, die 1884 beim Studium der Zersetzung des Gases in der Nähe von 8oo° Cels. stets eine Spur unzersetzten Ammoniaks beobachtet hatten, waren besonders bestrebt gewesen, bei der gleichen Temperatur diese Spur aus den Elementen mit Eisen als Uberträger zu erhalten. Aber der Versuch war mit den reinen Gasen erfolglos verlaufen. Hier lag eine Undeutlichkeit vor, deren Aufklärung über die Möglichkeit einer unmittelbaren Ammoniakerzeugung aus den Elementen entschied. Ich habe deshalb damit begonnen, durch ziemlich grobe Versuche die ungefähre Lage des Ammoniakgleichgewichtes in der Nähe von 1 ooo° Cels. zu bestimmen. Dabei erwies sich nun, dass die älteren Versuche nur durch einen Zufall negativ verlaufen waren; denn es gelang in der Nähe von 1 ooo° Cels. leicht, mit Eisen als Kontaktstoff den gleichen Ammoniakgehalt von beiden Seiten zu erreichen. Die Ergebnisse der einzelnen Versuche schwankten zwischen 1/200 % und 1/80 %, und ich sah damals wegen einzelner herausfallender Zahlen die obere Grenze als den wahrschein liehen Wert an, während sich später durch genauere Bestimmungen die untere als richtig herausgestellt und die Quelle der höheren Werte in der Eigenschaft der Katalysatoren gefunden hat, in frischem Zustande vorübergehend das Gleichgewicht überschiessende Ammoniakbildung herbeizuführen. Es ergab sich weiter, dass dasselbe Resultat mit Nickel wie mit Eisen zu erhalten war, und es wurden im Calcium und besonders im Mangan Kontaktstoffe gefunden, die auch bei niederer Temperatur einen Zusammentritt der Elemente herbeiführten. Bei i ooo° war die Reaktionsgeschwindigkeit ausreichend, um mit einer kleinen Menge fortlaufend eine vergleichsweise grosse Menge Ammoniak zu erzeugen. Durch eine Zirkulationseinrichtung, die den Gasstrom abwechselnd bei hoher Temperatur mit dem Metall in Berührung brachte und dann das Ammoniak bei gewöhnlicher Temperatur durch Auswaschen entfernte, Hess sich die Umbildung einer gegebenen Gasmasse zu Ammoniak schrittweise durchführen.
Aus der Bestimmung bei einem Druck, einer Temperatur und einer Ausgangsmischung von Stickstoff und Wasserstoff liess sich nach dem Stande der Theorie das erreichbare Ergebnis für beliebige Temperaturen, Drucke und Mischungsverhältnisse von Stickstoff und Wasserstoff annähernd voraussagen. Aus der formelmässigen Fassung war ohne weiteres die Erhöhung des erreichbaren Maximalgehaltes mit sinkender Temperatur, seine Proportionalität mit dem Gasdruck und die Tatsache vorauszusagen, dass eine Mischung von 3 Teilen Wasserstoff und 1 Teil Stickstoff die höchsten Ammoniakgehalte liefern musste. Am wesentlichsten war die damals gewonnene Einsicht, dass von beginnender Rotglut aufwärts kein Katalysator mehr als Spuren Ammoniak in der günstigsten Gasmischung erzeugen kann, wenn man bei gewöhnlichem Druck arbeitet, und dass auch bei stark erhöhtem Druck die Lage des Gleichgewichtes stets sehr ungünstig bleiben musste. Wenn man praktische Erfolge mit einem Katalysator bei gewöhnlichem Drucke erreichen wollte, so durfte man seine Temperatur nicht wesentlich über 300° steigen lassen. Damit schien mir im Jahre 1905 die weitere Verfolgung des Gegenstandes als aussichtslos gekennzeichnet. Die Herstellung der Verbindung aus den Elementen war wohl gelungen und die Bedingungen einer Synthese in grösserem Stil physikalisch gekennzeichnet. Aber diese Bedingungen erschienen so ungünstig, dass sie von einer Vertiefung in den Gegenstand abschreckten. Denn die Auffindung von Kontaktstoffen, die noch in der Nähe von 300° eine flotte Einstellung des Gleichgewichtes bei gewöhnlichem Drucke lieferten, war mir völlig unwahrscheinlich. Sie sind auch in den inzwischen verflossenen 15 Jahren nirgends gefunden worden. Eine Durchführung der bei gewöhnlichem Drucke nachgewiesenen Ammoniakbildung unter hohem Druck konnte im Laboratoriumsmasstabe keine ernstliche Schwierigkeit haben. Es bedurfte dazu nur einer geringen Umbildung des Druckofens, mit dem Hempel 15 Jahre früher die Stickstoffaufnahme bei der indirekten Ammoniakbildung unter Drucken bis zu 66 Atm. verfolgt hatte. Aber ich hielt sie nicht der Mühe für wrert; denn ich unterlag damals dem verbreiteten Urteil, dass die technische Durchführung einer Gasreaktion bei beginnender Rotglut unter hohem Drucke unmöglich sei. Auf diesem Stande verblieb die Sache während der nächsten 3 Jahre. Hingegen erwies sich eine neue Bestimmung des Ammoniakgleichgewichtes schon 1906 als erforderlich. Im Gange seiner Untersuchungen über das nach ihm benannte Wärmetheorem war Herr Nernst zu einer Näherungsformel gelangt, die aus den Werten der Wärmetönung und der sogenannten chemischen Konstanten eine Voraussage der Gleichgewichte erlaubte. Sie ergab beim Ammoniak eine Abweichung von den aus meinen ersten Bestimmungen gefolgerten Werten, die, wie später ersichtlich wurde, durch den damals benutzten Erstwert der konventionellen chemischen Konstante des Wasserstoffs hervorgerufen war. Diese Abweichung führte zu neuen Gleichgewichtsbestimmungen, die Herr Nernst in seinem Institut mit einem von ihm angegebenen Druckofen ausführen liess, während ich in Gemeinschaft mit Robert le Rossignol die Bestimmungen unter gewöhnlichem Drucke mit grösserer Sorgfalt als früher wiederholte. Weitere Arbeiten folgten, die der Feststellung des Gleichgewichtes bei gewöhnlichem Druck und bei 30 Atmosphären in einem erweiterten Temperaturbereich der Ermittlung der Bildungswärme des Ammoniaks aus den Elementen bei gewöhnlicher Temperatur und an der Schwelle der Rotglut und schliesslich der Kenntnis seiner spezifischen Wärme bei erhöhter Temperatur gewidmet waren.
Im Gange dieser Untersuchungen bin ich 1908 in Gemeinschaft mit meinem jüngeren Freunde und Mitarbeiter Robert le Rossignol, dessen ich an dieser Stelle mit besonderer Herzlichkeit und besonderem Danke gedenke, an die 3 Tahre früher verlassene Aufgabe der Ammoniakdarstellung wieder herangetreten. Ich war unmittelbar zuvor mit den Arbeitshilfsmitteln der Luftverflüssigung vertraut geworden, hatte gleichzeitig Einblick in die Formiatindustrie erhalten, die strömendes Kohlenoxyd auf Alkali in der Wärme unter erhöhtem Drucke zur Einwirkung brachte, und hielt es nicht mehr für ausgeschlossen, in technischem Masstabe Ammoniak bei hohem Druck und hoher Temperatur zu erzeugen. Aber die ungünstige Beurteilung durch die Fachgenossen belehrte mich, dass es eines eindrucksvollen Fortschrittes bedurfte, um das technische Interesse für den Gegenstand zu wecken.
Es war zunächst klar, dass der Übergang zu möglichst hohem Drucke vorteilhaft war. Die Lage des Gleichgewichtes wurde dadurch günstiger, und für die Reaktionsgeschwindigkeit liess sich das gleiche erwarten. Der Kompressor, über den wir verfügten, erlaubte die Verdichtung der Gase auf 200 Atm. und bestimmte damit den Arbeitsdruck, der für grössere Versuchsreihen nicht bequem zu überschreiten war. In der Nähe dieses Druckes lieferten die Katalysatoren, mit denen wir durch die Gleichgewichtsbestimmungen bekannt geworden waren, vorzugsweise Mangan, nächst ihm Eisen, oberhalb 700° mit Leichtigkeit eine rasche Vereinigung des Stickstoffs mit dem Wasserstoff. Für ein eindrucksvolles Ergebnis aber bedurfte es der Auffindung von Kontakten, die zwischen 500 und 6oo° einen flotten Umsatz herbeiführten. Wir kamen auf den Gedanken, die sechste, siebente und achte Gruppe des periodischen Systems, deren Spitzenmetalle Chrom, Mangan, Eisen und Nickel ein ausgeprägtes katalytisches Vermögen besassen, nach Metallen zu durchsuchen, die noch günstiger wirkten, und entdeckten solche im Uran und Osmium. Dabei fanden wir für die grosse Abhängigkeit, in der die Leistung eines Kontaktes von der Art seiner Herstellung stand, beim Osmium ein besonders ausgeprägtes Beispiel. Mit ihrer Hilfe liessen sich bei 200 Atm. die beiden Forderungen erfüllen, die wir an eine technisch überzeugende Ausführung des Versuches stellen zu müssen glaubten; die eine betraf den Gehalt an Ammoniak, die andere die pro ccm des Kontaktraumes und Stunde erzeugte Ammoniakmasse: mit einem Gehalte von rund 5 % war die 1905 beschriebene Umlaufsvorrichtung nicht mehr die Darstellung einer Bildungsweise, sondern ein Herstellungsverfahren Bei einer Ausbeute von mehreren Grammen Ammoniak pro Stunde und ccm des geheizten Hochdruckraumes konnten dessen Abmessungen so klein bleiben, dass die Bedenken der Industrie nach unserer Auffassung schwinden mussten.
Es bedurfte schliesslich noch eines Aufbaues der Zirkulationseinrichtung, die als ein Modell der technischen Durchführung gelten konnte. Es wäre nicht zweckmässig gewesen, die Bildung und die Entfernung des Ammoniaks aus dem Gasstrom durch eine Entspannung zu trennen. Der Wechsel von Ammoniakerzeugung und Ammoniakabscheidung musste offenbar bei konstantem Hochdruck am einfachsten durchführbar sein. Wesentlich erschien, dass die bei der Ammoniakbildung erzeugte Wärme den vom Kontakt abziehenden Gasen, in denen sie lediglich störend wirkte, entzogen und aut das Frischgas übertragen wurde, damit der Vorgang die für seinen Ablauf erforderliche Temperatur durch seine eigene Wärmeerzeugung lieferte. Der gemeinsam mit Robert le Rossignol durchgeführte Bau und Betrieb einer kleinen Anordnung, die diesem Gesichtspunkte entsprach, verbunden mit der Leistung der erwähnten neuen Kontakte, genügten in der Tat, um die Badische Anilin- und Sodafabrik, die zuvor dem indirekten Wege der Ammoniakdarstellung mittels der Nitride des Aluminiums, des Siliciums und Titans ihre Arbeit gewidmet hatte, zur Aufnahme der Hochdrucksynthese aus den Elementen zu bestimmen.
Die Firma hat danach die Kontakte mit wesentlich grösseren Hilfsmitteln in weitem Umfange studiert und in der Temperatur, die bei ihrer Herstellung innegehalten wird, und besonders in dem absichtlichen Zusatz indifferenter Stoffe Mittel gefunden, um die Leistung schlechterer Katalysatoren auf die des Osmiums und Urans zu bringen. Das Ergebnis war namentlich wichtig bei dem klassischen Ammoniakkontakt, den Ramsay und Young für die Zerlegung bevorzugt hatten, nämlich dem Eisen. Für die Konstruktion des Ofens fand sie eine Verbesserung, die die bei längerem Gebrauche von ihr beobachtete Einwirkung des Wasserstoffs auf den Kohlenstoffgehalt des Stahls beseitigte. Die Hauptarbeit erwuchs der Firma aber aus der Vertauschung des elektrolytischen Wasserstoffs, mit dem unsere Versuche ausgeführt waren, gegen den Wasserstoff des Wassergases, der Verunreinigungen mit sich brachte. Die Schwierigkeiten, die der technische Leiter, Herr Dr. Bosch, zu überwinden hatte, ähneln denen, die sein Vorgänger Knietsch bei der technischen Durchführung des Schwefelsäure- Kontakt-Prozesses gleich erfolgreich bewältigt hat. Direktor Bosch hat aus der Synthese des Ammoniaks eine Grossindustrie gemacht.
Von äusseren Merkmalen der Laboratoriumsarbeit sind in dem heutigen Grossbetriebe der Arbeitsdruck in der Nähe von 200 Atm., die Arbeitstemperatur von ungefähr 500 und 6oo°, der Umlauf unter dauerndem Hochdruck, die Art der Wärmeübertragung vom Abgas auf das Frischgas erhalten geblieben.
In jüngster Zeit hat Claude eine Verbesserung des Verfahrens durch Verwendung höherer Drucke angekündigt. Das Druckgebiet in der Nähe von 200 Atm. ist seinerzeit nur darum gewählt worden, weil es nach dem Stande der Kompressortechnik die Grenze des bequem zugänglichen Bereiches darstellte. Ich bin selbst bei späteren Versuchen zusammen mit Herrn Greenwood bis auf 370 Atm. gegangen. Ein grundsätzliches Interesse hat der höhere Druck nur dann, wenn er die Temperatur der flotten Umsetzung erheblich hinabdrückt, ohne neue technische Schwierigkeiten zu schaffen.
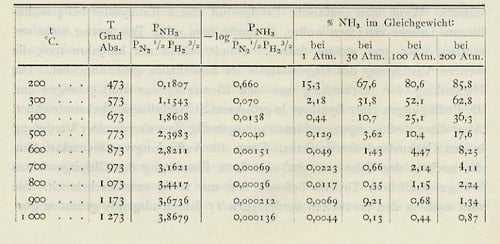
Aus der mitgeteilten Gleichgewichtstabelle ersieht man, dass der Übergang von gewöhnlichem Druck zu 200 Atm. die günstigen Gleichgewichtsbedingungen, die zwischen 200° und 300° Cels. bestehen, bei einer Temperatur schafft, die 300° höher liegt und die Katalysatoren zu kräftiger Wirkung befähigt. Warum es dafür der höheren Temperatur bedarf, ist eine Frage, deren Beantwortung wir einer erleuchteteren Periode der Wissenschaft überlassen müssen. Die heterogene Katalyse der Gasreaktionen ist ein Vorgang, dessen erste Phase anscheinend eine elektrodynamische Verzerrung des Moleküls durch die Atomfelder an der Grenze des festen Kontaktstoffes gegen den Gasraum, also eine Erscheinung aus einem Gebiete der Molekularphysik darstellt, in das wir durch Starcks Entdeckung eben erst den ersten Einblick getan haben.
Die Synthese des Ammoniaks aus den Elementen ist ein Ergebnis, das der physikalischen Chemie nicht entgehen konnte. Den Gedanken der Umkehrbarkeit des Ammoniakzerfalls haben schon Deville und Ramsay und Young gehabt. Le Chatelier hat den Temperatur- und Druck- einfluss schon 1901 überlegt. Misserfolg des ersten synthetischen Versuches aber hat ihn bestimmt, den Gegenstand zu verlassen und die angestellten Erwägungen nur in der Verborgenheit einer französischen Patentschrift unter fremdem Namen auszusprechen. Ich selbst habe erst längere Zeit nach dem erfolgreichen Abschluss meiner Versuche davon Kenntnis erhalten.
Die gefundene Lösung der Aufgabe nimmt ihre Bedeutung daher, dass das Gebiet der sehr hohen Temperaturen nicht betreten wird und das Verhältnis von Kohleaufwand zu Stickstofferzeugung darum günstiger ausfällt als bei anderen Verfahren. Das Ergebnis reicht anscheinend aus, um uns in Gemeinschaft mit den anderen Formen der Stickstoffbindung, die ich gestreift habe, der Zukunftssorge zu entheben, die uns die drohende Erschöpfung der Salpeterlager vor 20 Jahren bereitet hat.
Vielleicht ist diese Lösung keine endgültige. Die Stickstoff bakterien lehren, dass die Natur in den verfeinerten Formen der Lebenschemie noch Möglichkeiten kennt und verwirklicht, deren Nachahmung sich vorerst unserem Können entzieht. Genug, dass inzwischen neuer Reichtum an Nahrung der Menschheit aus reicherer Stickstoffdüngung des Bodens zufliesst und die chemische Industrie dem Landmann zu Hilfe kommt, der auf der friedlichen Erde Steine in Brot verwandelt.
Anmerkungen.
1.) Die Ergebnisse waren in Kürze die folgenden:
a) Wahre spezifische Wärme Cp des Ammoniakgases pro Mol bei konstantem Druck zwischen 309° und 523 Cels. Cp = 8,62 + 3,5 · 10-3 + 5,1 · 10-6 t2.
b) Bildungswärme Q des Ammoniakgases bei konstantem Druck in Grammkalorien pro Mol aus den Elementen bei t° Cels. Q = 10950 + 4,86 t – 0.93 · 10-3 t2 – 1,7 · 10-6 t3.
c) Prozentgehalte an Ammoniak im Gleichgewichte mit Stickstoff-Wasserstoffmischung
(3 Vol. H2 + 1 Vol. N2).
Für die Berechnung ist der Ausdruck benutzt:
![]()
Auch Ausdrücke mit höheren Gliedern für die Temperatur lassen sich den Beobachtungen anpassen. Ein rationeller Ausdruck wird erst aufgestellt werden können, wenn eine rationelle Darstellung der spezifischen Wärme aller 3 beteiligten Gase geglückt ist.
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 12 laureates' work and discoveries range from proteins' structures and machine learning to fighting for a world free of nuclear weapons.
See them all presented here.
