Nobelpriset i kemi 2003 – Populärvetenskaplig information
English
Swedish

8 oktober 2003
Allt levande består av celler. En enda människa har lika många celler som stjärnorna i en galax, ungefär 100 miljarder. De olika cellerna, t.ex. muskelceller, njurceller och nervceller, samverkar i ett intrikat system i var och en av oss. Årets Nobelpristagare i kemi, Peter Agre och Roderick MacKinnon, har bidragit till grundläggande kemisk kunskap om hur cellerna fungerar genom banbrytande upptäckter rörande cellernas vatten- och jonkanaler. De har fått upp våra ögon för en fantastisk familj av molekylära maskiner: kanaler, grindar och ventiler, som alla behövs för att cellen ska fungera.
Molekylära kanaler genom cellmembranet
För att upprätthålla ett jämnt tryck i cellerna är det viktigt att vatten kan passera genom cellmembranet. Detta har man känt till länge. Hur öppningarna verkligen ser ut och fungerar var dock under lång tid ett av biokemins olösta problem. Det var inte förrän runt 1990 som Peter Agre upptäckte den första vattenkanalen. Som så mycket annat i cellen var det ett protein det handlade om.
Vattenmolekyler är inte det enda som passerar in och ut i cellerna. För att miljardtals celler ska fungera som något annat än en stor cellklump krävs samordning. Kommunikation mellan cellerna är alltså nödvändig. De signaler som skickas inom och mellan cellerna består av joner eller små molekyler som sätter igång kaskader av kemiska reaktioner, vilket får våra muskler att spännas, ögon att fuktas – ja, som styr alla våra kroppsfunktioner. Även signalerna i hjärnan handlar om sådana reaktioner: När vi klämmer en tå skickas en signal upp till hjärnan. Längs en kedja av nervceller förs, genom ett växelspel mellan kemiska signaler och jonströmmar, informationen fram som en stafettpinne från cell till cell.
Det var år 1998 som Roderick MacKinnon första gången lyckades visa hur en jonkanal ser ut på atomär nivå – en insats som tillsammans med Agres upptäckt av vattenkanalerna öppnat helt nya forskningsområden inom biokemin och biologin.
De medicinska konsekvenserna av Agres och MacKinnons upptäckter är också stora. En rad sjukdomar kan hänföras till bristfällig funktion hos kroppens vatten- och jonkanaler, och med hjälp av den grundläggande kunskapen om hur kanalerna ser ut och fungerar, ser man nu möjligheter att kunna utveckla nya effektivare läkemedel.
 |
| Högupplöst bild (jpeg 201 kB) |
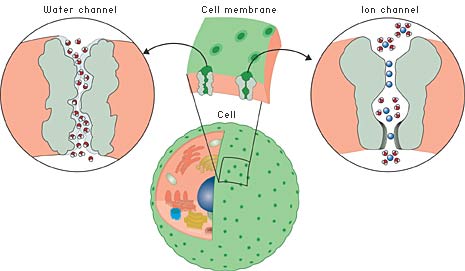
| Fig 1. Cellernas skiljevägg mot yttervärlden och andra celler – cellmembranet – är inget tätt skal. Tvärtom är det perforerat av olika kanaler. Många av dem är speciellt anpassade för just en viss jon eller molekyl och låter inte någon annan passera. Här ser vi till vänster en vattenkanal och till höger en jonkanal. |
Vattenkanaler
Jakten på vattenkanalerna
Redan i mitten av 1800-talet förstod man att det måste finnas öppningar i cellmembranen som tillåter ett flöde av vatten och salter. I mitten av 1950-talet upptäckte man att vatten snabbt kan transporteras in i och ut ur i celler genom öppningar som uteslutande släpper igenom vattenmolekyler. Under de kommande 30 åren studerades detta noga och man kom fram till att det måste finnas någon typ av selektivt filter som hindrar joner att passera genom membranet medan vattenmolekylerna, som är oladdade, flödar fritt. Det rör sig om tusen miljoner vattenmolekyler per sekund genom en enda kanal!
Trots denna insikt skulle det dröja ända till 1992 innan någon lyckades identifiera hur detta molekylära maskineri verkligen såg ut, dvs. identifiera vilket eller vilka proteiner som utgjorde själva kanalen. Under mitten av 80-talet studerade Peter Agre olika membranproteiner från människans röda blodkroppar. Ett av dessa hittade han även i njuren. Efter att ha bestämt både peptidsekvensen och motsvarande DNA-sekvens insåg han att detta måste vara det protein som så många letat efter före honom: cellernas vattenkanal.
Agre testade sin hypotes genom ett enkelt experiment (fig. 2) där han jämförde celler som innehöll det aktuella membranproteinet med celler utan detta protein. Då cellerna placerades i en vattenlösning visade det sig att de celler som hade proteinet i sitt cellmembran tog upp vatten genom osmos och svällde upp, medan de celler som saknade proteinet inte alls påverkades. Han gjorde också försök med konstgjorda celler, s.k. liposomer, som är ett slags såpbubblor omgivna på ut- och insidan av vatten. Han kunde konstatera att liposomerna blev genomsläppliga för vatten om proteinet planterades in i deras membran.
Vad är osmos?
Vätsketrycket i växt- och djurceller upprätthålls med hjälp av osmos. Osmos innebär att små molekyler (som vatten) passerar ett halvgenomträngligt membran. Om membranet inte släpper igenom makromolekyler eller salt som finns i högre koncentration på ena sidan membranet, kommer de små molekylerna (vattnet) att vandra över till denna sida, strävande efter att ”späda ut” det ämne som inte kan passera membranet. Det osmotiska tryck som därmed uppkommer är orsak till att celler ofta är uppsvällda och styva, t.ex. en blomstjälk.
 |
| Högupplöst bild (jpeg 165 kB) |
| Fig 2. Peter Agres experiment med celler med och utan akvaporin. Som framgår av bilderna krävs akvaporinet för att cellen ska kunna ta upp vatten och svälla. |
Peter Agre visste också att kvicksilverjoner hindrar celler att ta upp och släppa ut vatten, och han kunde visa att vattentransporten genom hans nya protein hindrades på samma sätt av kvicksilver. Detta gjorde honom ännu säkrare på att det faktiskt var vattenkanalen som han hade upptäckt. Agre gav proteinet namnet akvaporin, ”vattenpor”.
Hur fungerar vattenkanalen? En fråga om form och funktion
År 2000 rapporterade Agre tillsammans med andra forskarlag de första högupplösta bilderna på den tredimensionella strukturen hos akvaporinet. Med hjälp av dessa data har man nu kunnat kartlägga i detalj hur en vattenkanal fungerar. Hur kommer det sig att den bara släpper igenom vattenmolekyler och inte några andra molekyler eller joner? Membranet får t.ex. inte läcka protoner, eftersom en skillnad i protonkoncentration mellan in- och utsidan på cellen är grunden till cellens energilagringssystem.
Selektiviteten är en central egenskap hos kanalen. Vattenmolekylerna ålar sig igenom den trånga kanalen genom att orientera sig efter det lokala elektriska fält som bildas av kanalväggarnas atomer. Protoner (eller snarare oxoniumjoner, H3O+) hindras på vägen och stöts tillbaka på grund av sin positiva laddning.

Fig 3. Passage av vattenmolekyler genom akvaporinet AQP1. På grund av den positiva laddningen i kanalens mitt, repelleras positiva joner, t.ex. H3O+. Detta förhindrar protonläckage genom kanalen.
Vattenkanalernas medicinska betydelse
De senaste tio åren har vattenkanalerna utvecklats till ett hett forskningsfält. Akvaporinerna har visat sig vara en stor proteinfamilj. De finns i bakterier, växter och djur. Bara i människokroppen har man hittat minst elva olika varianter.
Man har nu kartlagt proteinernas funktion i bakterier såväl som hos växter och djur och fokuserat på deras fysiologiska roll. I oss människor
Njuren är en sinnrik apparat för att avlägsna ämnen som kroppen vill bli av med. I dess nystan (s.k. glomeruli) vilka fungerar som en sil, lämnar vatten, joner och andra små molekyler blodet som s.k. primärurin. Under ett dygn produceras ungefär 170 liter primärurin. Det mesta av denna återvinns med hjälp av en serie fiffiga mekanismer, så att det slutligen bara rör sig om ungefär en liter urin som lämnar kroppen varje dygn.
Från glomeruli flyter primärurinen genom ett slingrande rör i vars början ca 70% av vattnet återvinns till blodet via ett akvaporin (AQP1). I slutet av röret resorberas ytterligare 10% vatten med hjälp av ett snarlikt akvaporin (AQP2). Dessutom återupptas natrium-, kalium- och kloridjoner i blodet. Antidiuretiskt hormon (vasopressin) stimulerar transport av AQP2 till cellmembraner i rörets väggar och ökar därmed vattenupptaget från urinen. Människor som lider brist på detta hormon kan drabbas av sjukdomen diabetes insipidus med dygnsurinmängder på 10-15 liter.
Jonkanaler
Cellerna signalerar med salt!
Den förste fysikaliske kemisten, tysken Wilhelm Ostwald (Nobelpris i kemi 1909), föreslog år 1890 att de elektriska signaler man uppmätt i levande vävnad kunde orsakas av joner som rör sig ut och in genom cellmembran. Denna elektrokemiska idé fick snabbt spridning. Tanken på existensen av någon typ av trånga jonkanaler härstammar från 1920-talet. De båda brittiska forskarna Alan Hodgkin och Andrew Huxley stod för ett stort genombrott i början av 1950-talet, vilket belönades med Nobelpriset i fysiologi eller medicin år 1963. De visade hur jontransport genom nervcellsmembran åstadkommer en signal som förs vidare från nervcell till nervcell likt en stafettpinne. Det är framför allt jonslagen natrium och kalium, Na+ och K+, som är aktiva i dessa reaktioner.
Detta medförde att man redan för femtio år sedan hade en väl utvecklad kunskap om jonkanalernas centrala funktioner. De måste kunna selektivt släppa fram ett jonslag men inte ett annat. Likaså måste kanalerna kunna öppnas och stängas och ibland kunna leda joner åt bara ett håll. Hur detta molekylära maskineri egentligen fungerade skulle dock under lång tid förbli ett mysterium.
Jonselektiv kanal
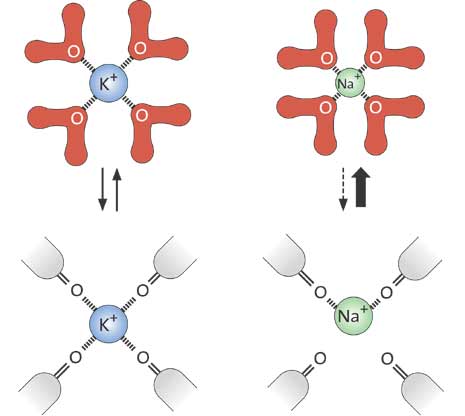
Under 1970-talet visade man att jonkanalernas förmåga att bara släppa igenom vissa joner berodde på att de var utrustade med något slags ”jonfilter”. Speciellt intressant var att man kunde konstatera att det finns kanaler som släpper igenom kaliumjoner men inte natriumjoner – trots att natriumjonen är mindre än kaliumjonen. Man misstänkte att proteinets syreatomer spelade en viktig roll som ”substitut” för de vattenmolekyler som kaliumjonen omger sig med i vattenlösning och som den sannolikt måste göra sig av med under inträdet i kanalen.
Längre kom man inte i sina hypoteser – det som krävdes för att komma vidare i förståelsen var helt enkelt högupplösta bilder av den kaliber som man bara kan få fram med röntgenkristallografi. Problemet var att membranproteiner är extremt svåra att strukturbestämma med denna metod och jonkanalerna utgjorde inte något undantag. Membranproteiner från växter och djur är mer komplicerade och svårare att arbeta med än de från bakterier. Att utgå från bakteriella kanalproteiner som liknar människans så mycket som möjligt, skulle kanske därför vara en väg framåt.
Många forskare försökte förgäves. Genombrottet kom från oväntat håll. Roderick MacKinnon hade efter att ha läst biokemi, tagit läkarexamen och därefter praktiserat som läkare ett antal år, blivit så intresserad av jonkanaler att han började forska i området: ”Min forskarkarriär började först när jag var trettio”, har han själv medgett. Men karriären tog snabbt fart. MacKinnon insåg att det krävdes bättre och mer högupplösta strukturer för att förstå hur jonkanalerna fungerade och lärde sig på kort tid grunderna i röntgenkristallografi. Sedan dröjde det bara några få år innan han slog hela forskarvärlden med häpnad genom att presentera en struktur av en jonkanal. Detta var i april 1998.
Första jonkanalen kartlagd – atom för atom
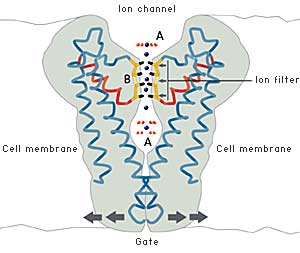
År 1998 lyckades alltså MacKinnon bestämma den första högupplösta strukturen av en jonkanal, kallad KcsA, från bakterien Streptomyces lividans. MacKinnon kunde för första gången avslöja hur en jonkanal fungerar på atomär nivå. Jonfiltret, som släpper förbi kalium- men stoppar natriumjoner, kunde nu detaljstuderas. Inte nog med att man kunde förstå hur jonerna passerar genom kanalen, man kunde dessutom se dem i kristallstrukturen – omgivna av vattenmolekyler just innan de träder in genom jonfiltret, mitt inne i filtret och när de möter vattnet på andra sidan om filtret (fig. 4). MacKinnon kunde förklara varför kaliumjoner men inte natriumjoner släpps igenom filtret: avstånden mellan kaliumjonen och syreatomerna i filtret är nämligen detsamma som mellan kaliumjonen och syreatomerna i de vattenmolekyler som omger kaliumjonen när den är utanför filtret. Den kan därför glida igenom filtret utan att märka något motstånd. Natriumjonen är mindre än kaliumjonerna men kan paradoxalt nog inte passera genom kanalen. Den passar nämligen inte lika bra in mellan syreatomerna i filtret och stannar därför kvar i vattenlösningen. Kanalens förmåga att ”klä av” kaliumjonen dess vatten och låta den passera utan energikostnad är ett slags selektivt katalyserad transport.
Cellen måste också kunna kontrollera öppning och stängning av jonkanalerna. MacKinnon har visat att detta sker genom att en ventil i botten av kanalen öppnas och stängs med hjälp av en sorts molekylär “sensor”. Sensorn sitter påkopplad nära den reglerbara öppningen. Olika sensorer reagerar på olika signaler, t.ex. en ökning av Ca+-koncentrationen, en elektrisk spänning över cellmembranet eller en inbindning av en signalmolekyl av något slag. Genom att koppla olika sensorer till jonkanaler har naturen skapat kanaler som reagerar på en hel rad olika signaler.
| Fig 4. Jonkanalen släpper igenom kaliumjoner men inte natriumjoner. Syreatomen i jonfiltret bildar en omgivning som liknar den kaliumjonen har utanför filtret. Cellen kan dessutom kontrollera öppning och stängning av kanalen. |
 |
| Högupplöst bild (jpeg 137 kB) |
| UTANFÖR JONFILTRET (A ovan) Utanför cellmembranet är jonerna bundna till vattenmolekyler med bestämda avstånd till vattnets syreatomer. |
| I JONFILTRET (B ovan) För kaliumjonernas del är avståndet till syreatomerna i jonfiltret detsamma som i vatten. |
Natriumjonen, som är mindre än kaliumjonen, passar inte mellan syreatomerna i kanalen. Detta förhindrar att natriumjonen släpps igenom kanalen. |
Förståelse för många sjukdomstillstånd
Cellernas membrankanaler är en förutsättning för allt levande. Därför blir en fördjupad förståelse för kanalernas funktion också en viktig hörnsten för att förstå många sjukdomstillstånd. Uttorkning av olika slag, liksom värmekänslighet, har med akvaporinernas effektivitet att göra. Senaste årens värmeböljor i Europa har t.ex. resulterat i många dödsfall, där orsaken ibland varit att dessa individer inte kunnat upprätthålla vätskebalansen. I detta sammanhang har akvaporinerna en avgörande betydelse, både då det gäller svettkörtlarnas funktion och urinproduktionen. Störningar i jonkanalfunktionen kan leda till allvarliga sjukdomstillstånd, i nervsystemet såväl som i muskler, t.ex. hjärtmuskeln. Detta gör jonkanaler intressanta för läkemedelsindustrin.
Illustrationer: Typoform
Pristagarna
Peter Agre
Dept. of Biological Chemistry
420 Physiology Building
Johns Hopkins University School of Medicine
725 North Wolfe Street
Baltimore Maryland 21205
USAAmerikansk medborgare. Född 1949 (54 år) i Northfield, Minnesota, USA. Grundexamen i kemi vid Augsburg College, Minneapolis (B.A. 1970). Medicine doktor vid Johns Hopkins University School of Medicine, Baltimore, 1974. Professor i biologisk kemi samt professor i medicin vid Johns Hopkins University School of Medicine i Baltimore sedan 1993.
Roderick MacKinnon
Howard Hughes Medical Institute
Laboratory of Molecular Neurobiology and Biophysics
The Rockefeller University
1230 York Avenue, New York,
New York 10021
USA
Amerikansk medborgare. Född 1956 (47 år). Uppvuxen i Burlington utanför Boston, USA. Grundexamen i biokemi vid Brandeis University i Boston (B.A. 1978). Medicine doktor vid Tufts Medical School i Boston 1982. Professor i molekylär neurobiologi och biofysik vid The Rockefeller University i New York sedan 1996.
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 14 laureates' work and discoveries range from quantum tunnelling to promoting democratic rights.
See them all presented here.