Pressmeddelande: Nobelpriset i fysiologi eller medicin 2016
English
English (pdf)
Swedish
Swedish (pdf)
![]()
2016-10-03
Nobelförsamlingen vid Karolinska Institutet har idag beslutat att
Nobelpriset i fysiologi eller medicin år 2016
skall tilldelas
Yoshinori Ohsumi
för hans upptäckter av mekanismer för autofagi
Sammanfattning
Årets Nobelpristagare har upptäckt och klarlagt maskineriet som styr autofagi, en fundamental process för nedbrytning och återvinning av cellens egna beståndsdelar.
Begreppet autofagi härstammar från grekiskans auto som betyder “själv” och phagein som betyder “äta”. Autofagi betyder alltså “självätande”. Begreppet myntades under 1960-talet då man observerade hur delar av cellens innehåll omslöts av membran och bildade så kallade vesiklar som sedan transporterades vidare till lysosomen, en cellulär återvinningsstation för nedbrytning av biologiskt material. På grund av svårigheter att studera fenomenet var det mesta okänt fram till dess att Yoshinori Ohsumi genom en serie briljanta experiment i vanlig bagerijäst under tidigt 1990-tal identifierade gener som har betydelse för autofagi. Med dessa kunskaper som utgångspunkt kunde han sedan klarlägga de bakomliggande mekanismerna och visa att även celler från människa använder samma sofistikerade maskineri.
Ohsumis upptäckter har resulterat i ett paradigmskifte i vår förståelse av hur celler bryter ner och återvinner cellulärt material. Genom att studera det maskineri som Ohsumi upptäckt, vet vi idag att autofagi är fundamentalt för viktiga fysiologiska processer, bland annat för cellers förmåga att hantera näringsbrist och infektioner. Mutationer i gener av betydelse för autofagi kan orsaka ärftliga sjukdomar. Störningar i autofagi-processen kan bidra till bland annat cancer och neurologiska sjukdomar.
Avfallshantering – en livsviktig uppgift i cellen
I mitten av 1950-talet upptäcktes en ny cellulär “arbetsstation”, en organell, som visade sig innehålla de enzymer som bryter ner proteiner, kolhydrater och fettmolekyler. Den benämndes “lysosom” och ansågs vara en slags avfallsstation anpassad till att omhänderta cellulära beståndsdelar. Den belgiske forskaren Christian de Duve tilldelades 1974 års Nobelpris i fysiologi eller medicin för upptäckten av lysosomen. Nya observationer under 1960-talet visade att lysosomen kunde innehålla större mängder cellulära beståndsdelar och till och med hela organeller. Cellen verkade alltså använda en speciell mekanism för att transportera stora avfallslaster för lysosomal nedbrytning. Genom biokemiska och mikroskopiska undersökningar kunde en ny sorts vesiklar med cellulärt material identifieras. Vesiklarna bildades inne i cellen och sammansmälte sedan med lysosomen så att det membranomslutna cellulära innehållet kunde brytas ner (Figur 1). Lysosomens upptäckare, De Duve, var den forskare som gav processen ett träffande namn, autofagi, vilket betyder “självätande”. Vesiklarna kom att kallas “autofagosomer”.
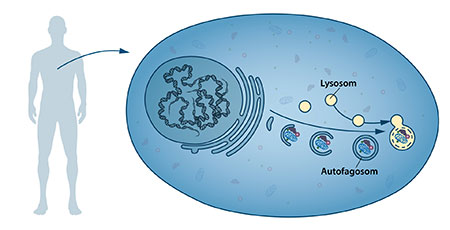
Figur 1: I våra celler finns specialiserade arbetsstationer. Lysosomen är en sådan arbetsstation och innehåller enzymer som kan bryta ner cellulära beståndsdelar. En ny typ av vesiklar som kom att kallas autofagosomer observerades under 1960-talet. Autofagosomerna bildas inne i cellen och tar upp cellulära beståndsdelar som till exempel skadade proteiner. När de sammansmälter med lysosomen bryts deras innehåll ner i mindre beståndsdelar som sedan kan återvinnas.
Under 1970 och 1980-talen pågick forskning om ett annat system för nedbrytning av proteiner i ett speciellt cellulärt maskineri kallat proteasomen. Inom detta forskningsområde belönades Aaron Ciechanover, Avram Hershko och Irwin Rose med 2004 års Nobelpris i kemi för upptäckten av “ubiquitinmedierad proteinnedbrytning”. Proteasomen kunde effektivt bryta ner ett protein i taget, men trots den nya kunskapen återstod ett fundamentalt problem: Hur kan cellen ta hand om större proteinkomplex och uttjänta organeller? Sker detta genom autofagi och hur fungerar i så fall processen?
Ett banbrytande experiment
Yoshinori Ohsumi hade bedrivit forskning inom flera olika områden, men då han startade sitt eget laboratorium 1988 riktade han sitt intresse mot processen för nedbrytning av proteiner i jästcellens vakuol, den struktur i jäst som motsvarar lysosomen i våra egna celler. Jästceller är relativt enkla att studera och används ofta som modell för mänskliga celler. Med jäst som modellsystem kan man använda storskaliga metoder för att hitta de gener som är viktiga i en cellulär process. Men Ohsumi stod inför en utmaning – jästcellen är liten och dess inre strukturer är svåra att urskilja även med hjälp av ett mikroskop. Vid den här tiden var det därför osäkert om autofagi ens existerade i jäst. Ohsumi resonerade att om nedbrytningsprocessen i vakuolen hämmas samtidigt som autofagiprocessen var aktiv, borde de membranomslutna autofagosomerna ansamlas inne i vakuolen. Kanske skulle detta fenomen då bli synligt under mikroskopet. Ohsumi använde muterade jästceller som saknade några av vakuolens nedbrytningsenzymer och aktiverade samtidigt autofagi genom att odla cellerna i näringsfattigt odlingsmedium. Resultatet var slående! Redan efter några timmar kunde Ohsumi se att vakuolerna var fulla av små membranomslutna blåsor som inte kunnat brytas ner (se Figur 2). Vesiklarna var autofagosomer och experimentet visade att autofagi existerade i jäst. Ännu mer betydelsefullt var att Ohsumi nu hade tillgång till en metod för att identifiera och studera gener viktiga för autofagi. Detta var ett stort genombrott och resultaten publicerades 1992.

Figur 2: I jästceller (bilden till vänster) finns en stor avgränsad del av cellen som kallas vakuol. Vakuolen motsvarar lysosomen i däggdjursceller. Ohsumi framställde jästceller utan vakuolens nedbrytningsenzymer. När de utsattes för stress fylldes vakuolen av autofagosomer som inte kunde brytas ned (bilden i mitten). Experimentet visade att autofagi förekommer i jäst. I nästa steg använde Ohsumi jästceller i ett omfattande experiment för att identifiera de 15 första generna som behövs för att autofagi ska fungera (bilden till höger).
Generna viktiga för autofagi identifieras
Ohsumi använde jästcellerna i vilka autofagosomer ansamlades under näringsbrist. Om en gen viktig för autofagi blivit inaktiverad borde autofagosomerna inte kunna ansamlas i vakuolen, ett fenomen som skulle kunna urskiljas under mikroskop. I laboratoriet utsattes därför jästcellerna för en kemikalie som slumpmässigt framkallar mutationer. Därefter aktiverades autofagi genom att jästcellerna odlades i näringsfattigt medium. Strategin fungerade! Inom ett år efter det genombrott som påvisat autofagi i jäst, hade 15 nya gener viktiga för autofagiprocessen identifierats. I en serie eleganta studier lyckades Ohsumi och hans medarbetare därefter förklara funktionen hos de proteiner som kodas av de identifierade generna. De visade hur jästcellerna använder olika proteiner och proteinkomplex som vart och ett styr olika skeden under autofagosomens bildande (se Figur 3).
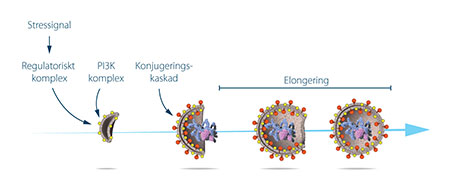
Figur 3: Ohsumi studerade de proteiner som de 15 autofagigenerna utgör mall för. Han visade att kaskadens startpunkt är en stressignal, och att proteiner och proteinkomplex stegvis formar auto-fagosomens membran som sedan sluts och bildar autofagosomen.
Autofagi – en livsnödvändighet för våra celler
Efter att ett maskineri för autofagi i jäst blivit identifierat återstod en nyckelfråga. Regleras autofagi genom en liknande mekanism i andra organismer? Fortsatt forskning påvisade snart att ett närmast identiskt maskineri styr processen i våra egna celler. Därmed fanns tillgång till de verktyg som behövdes för att utreda autofagins betydelse även hos människa.
Tack vare Ohsumi och de många forskare som följt i hans fotspår vet vi nu att autofagi kontrollerar viktiga fysiologiska processer där cellulära beståndsdelar behöver brytas ner och återvinnas. Autofagi ger cellen snabb tillgång till bränsle för energifrisättning och byggstenar för återuppbyggnad, vilket är livsnödvändigt vid näringsbrist och andra typer av stress. Autofagi bidrar också till att invaderande bakterier och virus kan oskadliggöras. Under embryoutvecklingen är autofagi betydelsefullt för utmognad av celler och vävnader. Under åldrandet skyddar autofagi våra celler genom att eliminera skadade och förbrukade proteiner och organeller.
Nedsatt autofagifunktion kan kopplas till Parkinsons sjukdom, typ 2 diabetes och andra sjukdomar som uppträder då vi blir äldre. Vissa ärftliga sjukdomar orsakas av mutationer i autofagigener. Autofagi är även inblandat i utvecklingen av cancer. Intensiv forskning pågår idag för att utveckla läkemedel som kan påverka autofagiprocessen och därigenom motverka allvarliga sjukdomstillstånd.
Autofagi har varit ett känt fenomen i över 50 år men först genom Yoshinori Ohsumis paradigmskiftande genombrott under 1990-talet kunde autofagins fundamentala betydelse för fysiologi och medicin klarläggas. För dessa upptäckter belönas han med årets Nobelpris i fysiologi eller medicin.
Nyckelpublikationer
Takeshige, K., Baba, M., Tsuboi, S., Noda, T., Ohsumi, Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. Journal of Cell Biology 119, 301-311
Tsukada, M., Ohsumi, Y. (1993). Isolation and characterization of autophagy-defective mutants of Saccharomyces cervisiae. FEBS Letters 333, 169-174
Mizushima, N., Noda, T., Yoshimori, T., Tanaka, Y., Ishii, T., George, M.D., Klionsky, D.J., Ohsumi, M., Ohsumi, Y. (1998). A protein conjugation system essential for autophagy. Nature 395, 395-398
Ichimura, Y., Kirisako T., Takao, T., Satomi, Y., Shimonishi, Y., Ishihara, N., Mizushima, N., Tanida, I., Kominami, E., Ohsumi, M., Noda, T., Ohsumi, Y. (2000). A ubiquitin-like system mediates protein lipidation. Nature, 408, 488-492
Yoshinori Ohsumi föddes 1945 i Fukuoka, Japan. Han doktorerade 1974 vid Tokyo University. Efter en 3-årig vistelse vid Rockefeller University, New York, USA, återvände han till Tokyo University där han etablerade sin forskargrupp 1988. Sedan 2009 är han professor vid Tokyo Institute of Technology.
Nobelförsamlingen, som består av 50 professorer vid Karolinska Institutet, utser Nobelpristagare I fysiologi eller medicin. Utredningsarbetet genomförs av dess Nobelkommitté. Nobelpriset har sedan 1901 belönat de forskare som gjort de viktigaste upptäckterna till mänsklighetens nytta.
Nobelpriset® är Nobelstiftelsens registrerade varumärke
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 14 laureates' work and discoveries range from quantum tunnelling to promoting democratic rights.
See them all presented here.
