Pressmeddelande: Nobelpriset i fysiologi eller medicin 2019
English
English (pdf)
Swedish
Swedish (pdf)
![]()
Pressmeddelande
2019-10-07
Nobelförsamlingen vid Karolinska Institutet har idag beslutat att
Nobelpriset i fysiologi eller medicin år 2019
skall delas lika mellan
William G. Kaelin Jr., Sir Peter J. Ratcliffe och Gregg L. Semenza
för deras upptäckter av hur celler känner av och anpassar sig efter syretillgång
SAMMANFATTNING
Djur behöver syre för att i sina celler omvandla föda till användbar energi. Syrets fundamentala betydelse har varit känd under lång tid men hur celler anpassar sig efter syretillgänglighet förblev länge okänt.
William G. Kaelin, Jr., Sir Peter J. Ratcliffe och Gregg L. Semenza upptäckte hur celler känner av och anpassar sig till förändrade syrenivåer. Deras forskning identifierade ett molekylärt maskineri som reglerar geners aktivitet som svar på varierande syrenivåer.
Nobelpristagarna banbrytande upptäckter har förklarat mekanismen bakom en livsnödvändig anpassningsförmåga. De lade grunden för vår förståelse av hur syrenivåer påverkar cellens ämnesomsättning och fysiologiska processer. Deras upptäckter har också lett fram till nya lovande strategier för att bekämpa blodbrist, cancer och många andra sjukdomar.
Vårt livsviktiga syre
Syre med den kemiska beteckningen O2 utgör ungefär en femtedel av gaserna i vår atmosfär. I djurriket är O2 livsnödvändigt. Alla våra celler behöver O2 för att i en syreberoende process i cellernas energifabriker (mitokondrierna) kunna omvandla födoämnen till användbar energi. Otto Warburg, mottagare av Nobelpris i fysiologi eller medicin 1931, visade att detta är en enzymatisk process.
Under evolutionen har mekanismer utvecklats för att säkra den livsviktiga syretillförseln. Karotiskroppen, belägen i anslutning till halsens stora blodkärl, innehåller specialiserade celler som kan känna av blodets syrenivåer och aktivera de nervbanor som styr vår andning. 1938 års Nobelpris i fysiologi eller medicin till Corneille Heymans belönade upptäckter kring hur blodets syrenivåer kan avläsas och styra vår andningsfrekvens.
HIF intar scenen
Utöver den snabba anpassningen styrd från karotiskroppen vid låga syrenivåer (hypoxi) sker en mer långsam anpassning i kroppens celler. Bland annat ökar nivåerna av hormonet erytropoietin (EPO) som stimulerar nybildning av röda blodkroppar och därmed ökar blodets syretransporterande förmåga. Hormonets betydelse för blodbildning var känd redan i början på 1900-talet men hur nivåerna regleras förblev länge en gåta.
Gregg Semenza studerade EPO-genen och hur den kontrolleras av varierande syrenivåer. Han använde genmodifierade möss och kunde i anslutning till EPO-genen påvisa DNA-segment som behövs för genens aktivering vid hypoxi. Sir Peter Ratcliffe studerade också EPO-genens reglering och bägge forskargrupperna fann att den syrereglerade mekanismen var verksam i olika vävnader, inte bara i de celler i njuren där EPO normalt tillverkas. Det här var viktiga fynd. Nu förstod man att mekanismen var universell och kunde aktiveras i många olika celltyper.
Semenza ville identifiera de samverkande cellulära komponenterna och i odlade leverceller upptäckte han ett proteinkomplex som binder till DNA-segmentet på ett syreberoende sätt. Han kallade det för hypoxia-inducible factor (HIF). Ett omfattande reningsarbete tog vid och 1995 kunde Semenza publicera sina fynd. HIF visade sig bestå av två olika DNA-bindande proteiner, så kallade transkriptionsfaktorer, som nu benämns HIF-1α och ARNT. Nu kunde forskarna börja lägga pusslet för att förstå vilka ytterligare komponenter som påverkar cellernas fysiologi vid hypoxi, och hur maskineriet fungerar.
VHL: En oväntad partner
Vid höga syrenivåer innehåller celler mycket lite HIF-1α. Då syrenivåerna däremot är låga ökar dock mängden så att HIF-1α kan binda till och därmed reglera EPO-genen och andra gener som har HIF-bindande DNA segment (Figur 1). Flera forskargrupper visade att HIF-1α normalt bryts ner mycket snabbt men att proteinet skyddas från nedbrytning och anrikas vid hypoxi. Ett cellulärt maskineri kallat proteasomen, belönat med 2004 års Nobelpris i kemi till Aaron Ciechanover, Avram Hershko och Irwin Rose, används för att bryta ner HIF-1α vid normala syrenivåer. Under sådana normala betingelser adderas en liten peptid, ubiquitin, till HIF-1α. Ubiquitin fungerar som en adresslapp för de proteiner som ska brytas ner i proteasomen, men hur ubiquitin adderas till HIF-1α i närvaro av syre var en återstående och avgörande fråga.
Svaret kom från ett oväntat håll. Ungefär samtidigt som Semenza och Ratcliffe utforskade EPO-genens reglering studerade cancerforskaren William Kaelin, Jr. ett nedärvt syndrom, von Hippel-Lindaus sjukdom. Sjukdomen leder till förhöjd cancerrisk och orsakas av en genetisk defekt. I ett genombrottsarbete lyckades Kaelin bevisa att VHL-genen kodar för ett protein som hämmar uppkomst av cancer. I ett samarbetsprojekt visade Kaelin att cancerceller som saknar en funktionell VHL-gen producerar onormalt höga nivåer av hypoxi-reglerade gener, men då VHL-genen återinfördes i cancercellerna återställdes nivåerna. Det här var en viktig ledtråd som visade att VHL tycktes vara inblandad i maskineriet som kontrollerar cellernas svar på hypoxi. Ytterligare ledtrådar kom från flera forskargrupper som visade att VHL är en del i ett komplex som märker proteiner med ubiquitin för nedbrytning i proteasomen. Ett avgörande genombrott kom då Ratcliffe och hans forskargrupp visade att VHL behövs för att HIF-1α ska kunna brytas ner vid normala syrenivåer. Därmed hade kopplingen mellan VHL och HIF-1α etablerats.
Syrets centrala roll
Nu hade många av pusselbitarna fallit på plats. Men hur kan O2 reglera kontakten mellan VHL och HIF-1α så att proteinet skyddas från nedbrytning vid hypoxi? Man kände till att en specifik del av HIF-α-proteinet var viktig för dess VHL-beroende nedbrytning. Kaelin och Ratcliffe misstänkte att den regionen innehöll nyckeln till hypoxiregleringen. Deras jakt på en förklaring lyckades och genombrottet kunde 2001 presenteras i två samtidigt publicerade artiklar som visade att en syreatom adderas till två specifika positioner i HIF-1α vid normala syrenivåer (Figur 1). Denna förändring, som benämns prolyl-hydroxylering, gör att VHL kan känna igen och binda till HIF-1α. Upptäckten förklarade hur olika syrenivåer kan styra nedbrytningen av HIF-1α. Ytterligare forskning, bland annat från Ratcliffe, kunde identifiera de ansvariga syre-sensorerna, prolyl-hydroxylaserna. Det visades också att den genaktiverande funktionen i HIF-1α regleras genom en syreberoende hydroxylering. Nobelpristagarnas upptäckter hade därmed klarlagt det syrereglerade maskineriets byggstenar och funktion.
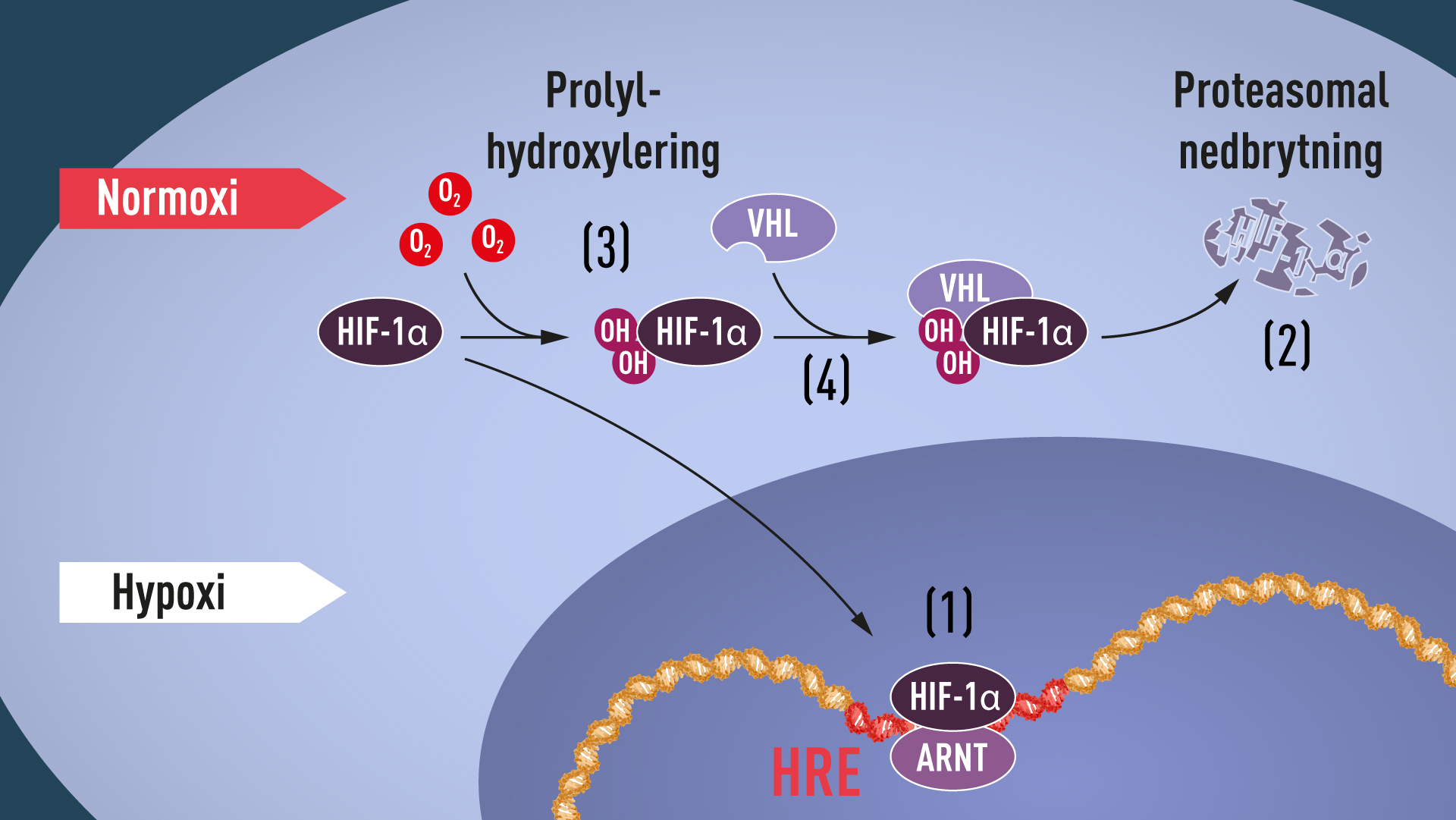
Figur 1. HIF-1α skyddas från nedbrytning vid låga syrenivåer (hypoxi) och bildar istället komplex med ARNT och binder till specifika DNA-sekvenser (HRE) i hypoxi-reglerade gener (1). Vid normala syrenivåer bryts HIF-1α ner i proteasomen (2). Syre reglerar nedbrytningsprocessen genom att ett syreberoende enzym adderar hydroxylgrupper (OH) till HIF-1α (3). VHL kan då känna igen och bilda ett komplex med HIF-1α vilket medför att proteinet bryts ner (4).
Syre påverkar fysiologi och sjukdom
Tack vare Nobelpristagarnas banbrytande upptäckter vet vi nu mycket mer om hur olika syrenivåer reglerar fundamentala delar av vår fysiologi. Regleringen gör det möjligt för celler att anpassa sin metabolism till låga syrenivåer, exempelvis i våra muskler vid hårt arbete. Blodkärlsbildning och produktion av röda blodkroppar är ytterligare exempel på processer som behöver anpassas till olika syrenivåer. Även vårt immunsystem och många andra fysiologiska funktioner finjusteras av det O2-reglerade maskineriet. Syreregleringen krävs också för den normala fosterutvecklingen, bland annat för fostrets blodkärlsbildning och utvecklingen av moderkakan (placenta).
Syreregleringen har även avgörande betydelse vid olika sjukdomstillstånd. Patienter med kronisk njursvikt lider ofta av svår blodbrist (anemi) till följd av minskad produktion av EPO, det hormon som produceras i njuren och kontrollerar nybildning av röda blodkroppar. Det syrereglerade maskineriet har stor betydelse även vid cancer. En snabbt växande cancertumör ställer stora krav på syre- och näringstillförsel. Cancercellerna utnyttjar det syrereglerade maskineriet för att stimulera blodkärlsbildning och också för att ställa om sin metabolism för effektiv tumörtillväxt. Intensiv aktivitet pågår för att utveckla nya läkemedel som kan påverka syreregleringen genom att antingen aktivera eller blockera maskineriet vid ett flertal olika sjukdomstillstånd.
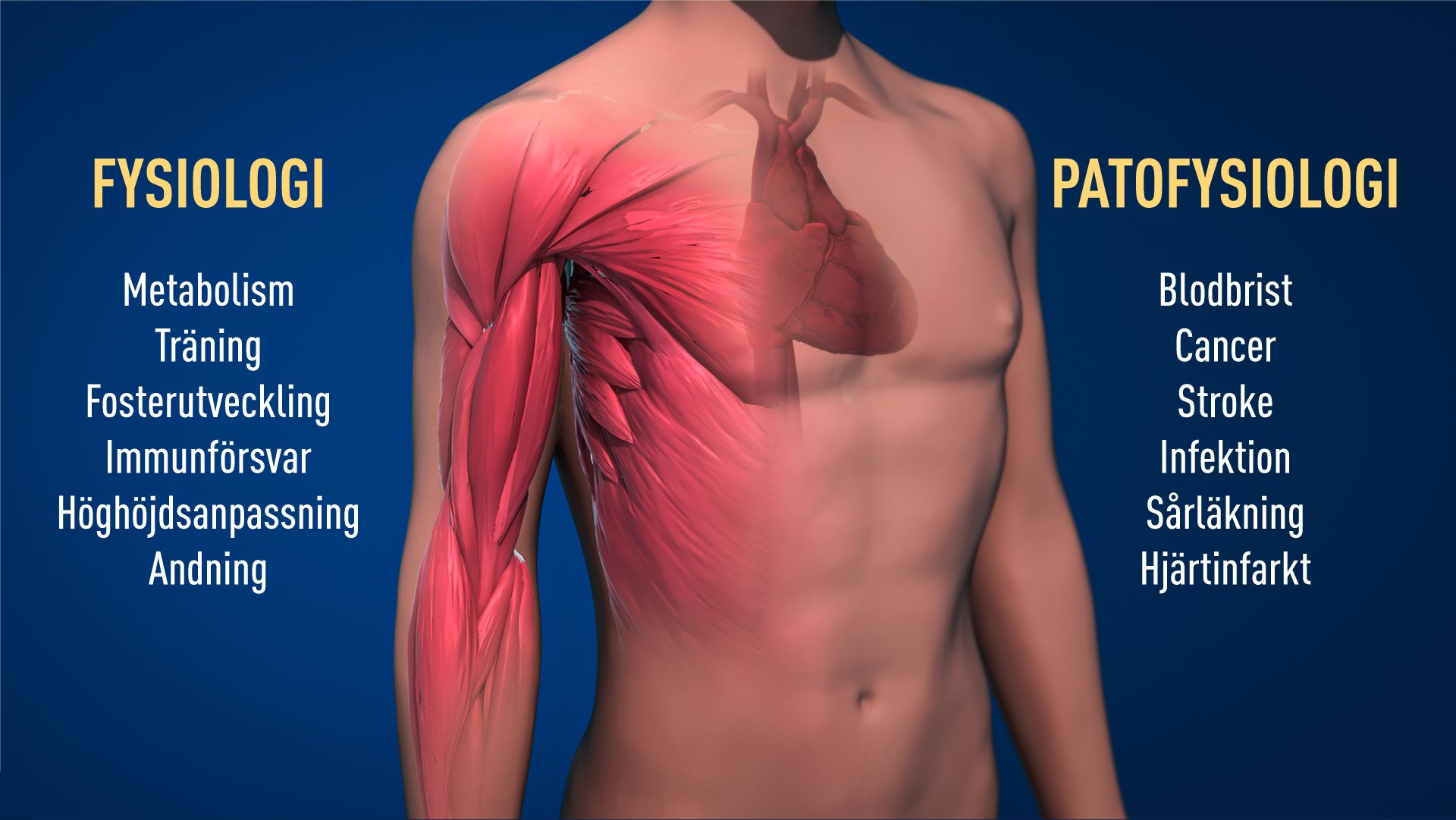
Figur 2. Den prisbelönade mekanismen har fundamental betydelse för vår fysiologi, bland annat för cellernas energimetabolism, för vårt immunförsvar och för hur våra vävnader svarar på träning. Ett flertal patologiska processer är också påverkade. Intensivt arbete pågår för att ta fram nya läkemedel som antingen kan stimulera eller hämma syreregleringen för behandling av anemi, cancer och andra sjukdomar.
Nyckelpublikationer
Semenza, G.L, Nejfelt, M.K., Chi, S.M. & Antonarakis, S.E. (1991). Hypoxia-inducible nuclear factors bind to an enhancer element located 3’ to the human erythropoietin gene. Proc Natl Acad Sci USA, 88, 5680-5684
Wang, G.L., Jiang, B.-H., Rue, E.A. & Semenza, G.L. (1995). Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension. Proc Natl Acad Sci USA, 92, 5510-5514
Maxwell, P.H., Wiesener, M.S., Chang, G.-W., Clifford, S.C., Vaux, E.C., Cockman, M.E., Wykoff, C.C., Pugh, C.W., Maher, E.R. & Ratcliffe, P.J. (1999). The tumour suppressor protein VHL targets hypoxia-inducible factors for oxygen-dependent proteolysis. Nature, 399, 271-275
Ivan, M., Kondo, K., Yang, H., Kim, W., Valiando, J., Ohh, M., Salic, A., Asara, J.M., Lane, W.S. & Kaelin Jr., W.G. (2001) HIFa targeted for VHL-mediated destruction by proline hydroxylation: Implications for O2 sensing. Science, 292, 464-468
Jaakkola, P., Mole, D.R., Tian, Y.-M., Wilson, M.I., Gielbert, J., Gaskell, S.J., von Kriegsheim, A., Heberstreit, H.F., Mukherji, M., Schofield, C.J., Maxwell, P.H., Pugh, C.W. & Ratcliffe, P.J. (2001). Targeting of HIF-a to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation. Science, 292, 468-472
William G. Kaelin, Jr. föddes 1957 i New York, USA. Han studerade medicin vid Duke University, Durham och tog examen (M.D.). Han genomgick klinisk specialistutbildning inom internmedicin och onkologi vid Johns Hopkins University i Baltimore och vid Dana-Farber Cancer Institute i Boston. Han bedrivit egen forskning vid Dana-Farber Cancer Institute och är sedan 2002 professor vid Harvard Medical School, Boston. Sedan 1998 är han forskare vid Howard Hughes Medical Institute.
Sir Peter J. Ratcliffe föddes 1954 i Lancashire, England. Han studerade medicin vid Gonville & Caius College, Cambridge University och genomgick klinisk specialistutbildning inom nefrologi i Oxford. Han etablerade en forskargrupp vid Oxford University och är professor vid samma universitet sedan 1996. Han är chef för Clinical Research vid Francis Crick Institute, chef för Target Discovery Institute i Oxford och forskare vid Ludwig Institute for Cancer Research.
Gregg L. Semenza föddes 1956 i New York, USA. Han studerade medicin och disputerade som MD/PhD vid University of Pennsylvania, School of Medicine, Philadelphia och blev sedan specialist i pediatrik vid Duke University, Durham. Han var postdoktor vid Johns Hopkins University, Baltimore där han även etablerade en forskargrupp. Sedan 1999 är han professor vid samma universitet och 2003 blev han chef för det vaskulära forskningsprogrammet vid Johns Hopkins Institute for Cell Engineering.
Illustrationer: © Nobelkommittén för fysiologi eller medicin. Illustratör: Mattias Karlén
Nobelförsamlingen, som består av 50 professorer vid Karolinska Institutet, utser Nobelpristagare I fysiologi eller medicin. Utredningsarbetet genomförs av dess Nobelkommitté. Nobelpriset har sedan 1901 belönat de forskare som gjort de viktigaste upptäckterna till mänsklighetens nytta.
Nobelpriset® är Nobelstiftelsens registrerade varumärke
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 14 laureates' work and discoveries range from quantum tunnelling to promoting democratic rights.
See them all presented here.
