Pressmeddelande: Nobelpriset i fysiologi eller medicin 2024
English
English (pdf)
Swedish
Swedish (pdf)

2024-10-07
Nobelförsamlingen vid Karolinska Institutet har idag beslutat att
Nobelpriset i fysiologi eller medicin år 2024
skall tilldelas
Victor Ambros och Gary Ruvkun
för upptäckten av mikroRNA och dess roll i posttranskriptionell genreglering
Årets Nobelpris belönar två forskare för upptäckten av en grundläggande princip för hur geners aktivitet regleras.
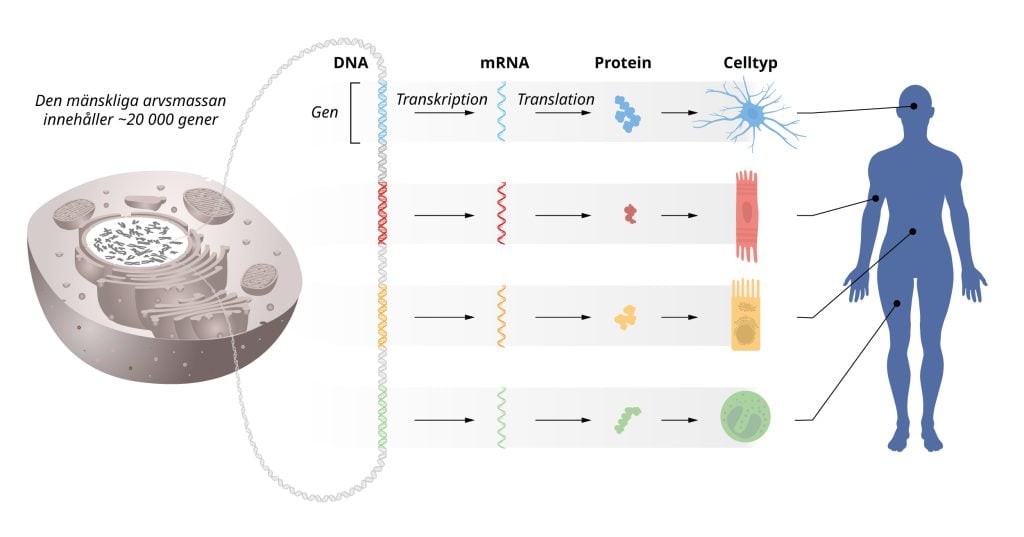
Arvsmassan i våra kromosomer kan liknas vid en instruktionsbok för kroppens celler. Alla celler innehåller samma kromosomer och därmed samma uppsättning gener, så instruktionen är identisk i alla celler. Trots detta har olika celltyper, till exempel muskel- och nervceller, unika egenskaper. Hur uppstår dessa skillnader? Svaret är att gener regleras så att varje cell bara läser av relevanta delar av instruktionsboken. På så sätt aktiveras rätt uppsättning gener i varje celltyp.
Victor Ambros och Gary Ruvkun var intresserade av hur olika celltyper bildas. De upptäckte att mikroRNA, en ny klass av mycket små RNA-molekyler, spelar en avgörande roll för genreglering. Deras banbrytande upptäckt beskrev en ny mekanism för hur gener regleras som visade sig vara essentiell för multicellulära organismer. Vi vet nu att människans arvsmassa innehåller fler än tusen gener som kodar för olika mikroRNA. Den överraskande upptäckten avslöjade en ny dimension av genreglering som visat sig ha en fundamental betydelse för organismers utveckling och funktion.
Livsviktig reglering
Årets Nobelpris rör upptäckten av en livsviktig reglermekanism som används i våra celler för att styra geners aktivitet. Flödet av genetisk information går från DNA till budbärar-RNA (mRNA), via en process som kallas transkription, och sedan vidare till cellernas maskineri för proteinframställning. Där blir mRNA avläst så att proteiner framställs enligt den genetiska instruktion som finns lagrad i DNA. Sedan mitten av 1900-talet har flera fundamentala vetenskapliga upptäckter beskrivit hur de här processerna går till.
Våra organ och vävnader består av många olika sorters celler, alla med identisk arvsmassa, men ändå med unika uppsättningar proteiner. Hur är detta möjligt? Svaret är att genernas aktivitet noggrant regleras så att rätt gener är aktiva vid rätt tidpunkt i de olika celltyperna. På så sätt erhåller exempelvis muskelceller, nervceller och tarmceller de olika funktioner de behöver. Dessutom behöver geners aktivitet ständigt finjusteras även i mogna celler, så att deras funktioner anpassas till förändrade förhållanden i kroppen och omgivningen. Felaktig genreglering kan leda till allvarliga sjukdomar såsom cancer, diabetes och autoimmunitet. Ett viktigt mål under många decennier har därför varit att förstå hur genreglering fungerar.
Under 1960-talet visade forskare att vissa proteiner, så kallade transkriptionsfaktorer, kan binda till kontrollregioner i DNA och därigenom styra vilka RNA som produceras. Sedan dess har tusentals transkriptionsfaktorer kartlagts och länge ansågs de huvudsakliga principerna för hur genreglering fungerar vara lösta. Men 1993 publicerade årets Nobelpristagare helt oväntade fynd som beskrev en ny nivå av genreglering, som visade sig ha stor betydelse och vara evolutionärt bevarad.
Forskning på en mycket liten mask leder till ett mycket stort genombrott
Under 1980-talet var Victor Ambros och Gary Ruvkun postdoktorer hos Robert Horvitz. Tillsammans med Sydney Brenner och John Sulston fick Horvitz Nobelpriset 2002 för upptäckter gjorda i en oansenlig, endast 1 mm lång, rundmask, C. elegans. Trots sin ringa storlek har C. elegans många av de specialiserade celltyper som återfinns i större och mer komplexa djur, exempelvis nerv- och muskelceller. Maskens egenskaper gör den till en utmärkt modellorganism för att undersöka hur vävnader utvecklas och mognar i flercelliga djur. Ambros och Ruvkun var intresserade av gener som kontrollerar tidsaxeln för när olika genetiska program aktiveras så att olika celltyper utvecklas vid rätt tidpunkt. De studerade två mutanter, lin-4 och lin-14, som uppvisade felaktiga genaktiveringsprogram under maskens utveckling. Ambros hade tidigare också visat att lin-4 genen verkade blockera lin-14-genens aktivitet. Hur lin-14-genens aktivitet blockerades var däremot oklart. Ambros och Ruvkun var fascinerade av de två mutanterna och beslöt sig för att lösa detta mysterium.
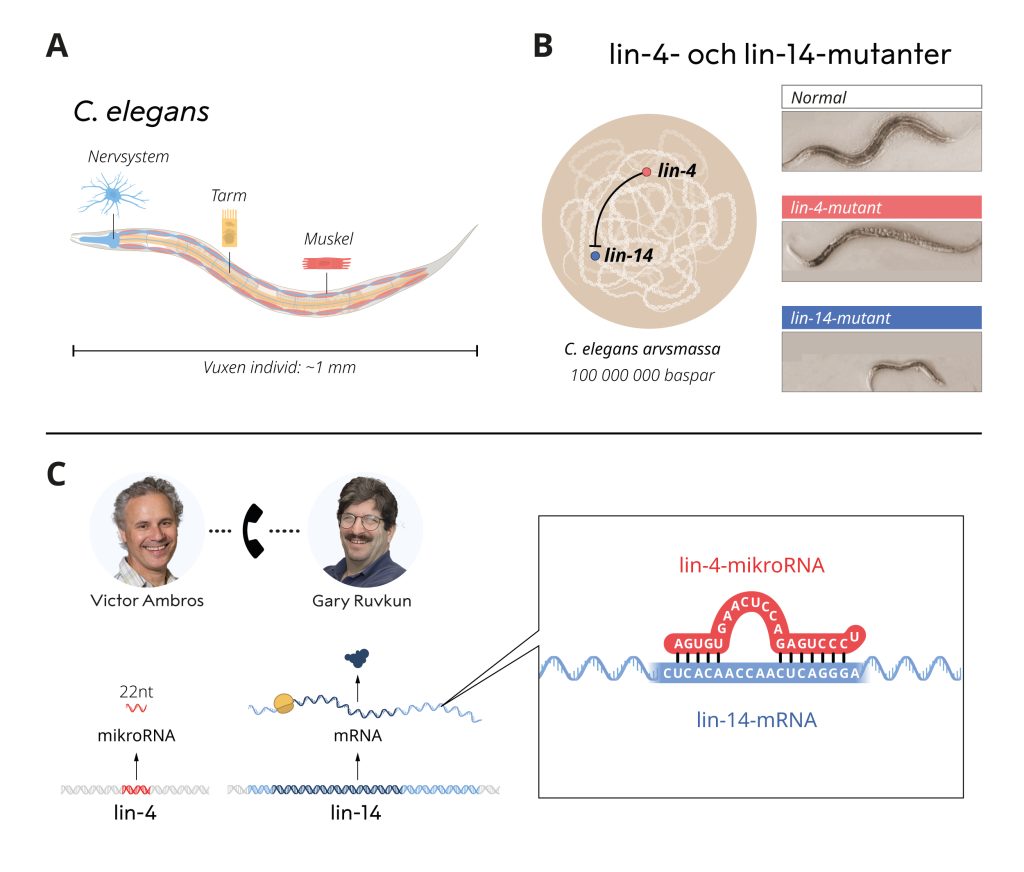
Efter tiden som postdoktor analyserade Victor Ambros lin-4-mutanten i sitt nystartade laboratorium vid Harvard University. Genom metodisk kartläggning klonade han genen och gjorde ett oväntat fynd. Från genen bildades en ovanligt kort RNA-molekyl som saknade en kod för proteinframställning. De förbryllande resultaten antydde att det var själva RNA-molekylen från lin-4 som utförde den blockerande funktionen. Hur kunde detta gå till?
Samtidigt studerade Gary Ruvkun lin-14-genens reglering i sitt nystartade laboratorium vid Massachusetts General Hospital och Harvard Medical School. Till skillnad från hur genreglering brukar fungera visade Ruvkun att det inte är omvandlingen av lin-14-genen till mRNA som hämmas av lin-4. Regleringen föreföll i stället inträffa under ett senare skede, genom avstängning av proteinproduktionen. Experimenten påvisade också vilken del av lin-14-genens mRNA som krävdes för att hämma produktionen av lin-14 protein. De två forskargrupperna jämförde sina fynd, vilket ledde till en banbrytande upptäckt. Sekvenser i lin-14 visade sig vara komplementära till lin-4 sekvensen. Ambros och Ruvkun utförde ytterligare experiment som visade att lin-4 mikroRNA-molekylen stängde av lin-14 genom att binda till de komplementära sekvenserna i lin-14 genens mRNA. En ny form av genreglering, förmedlad av mikroRNA, hade upptäckts! Resultaten publicerades 1993 i två artiklar i tidskriften Cell.
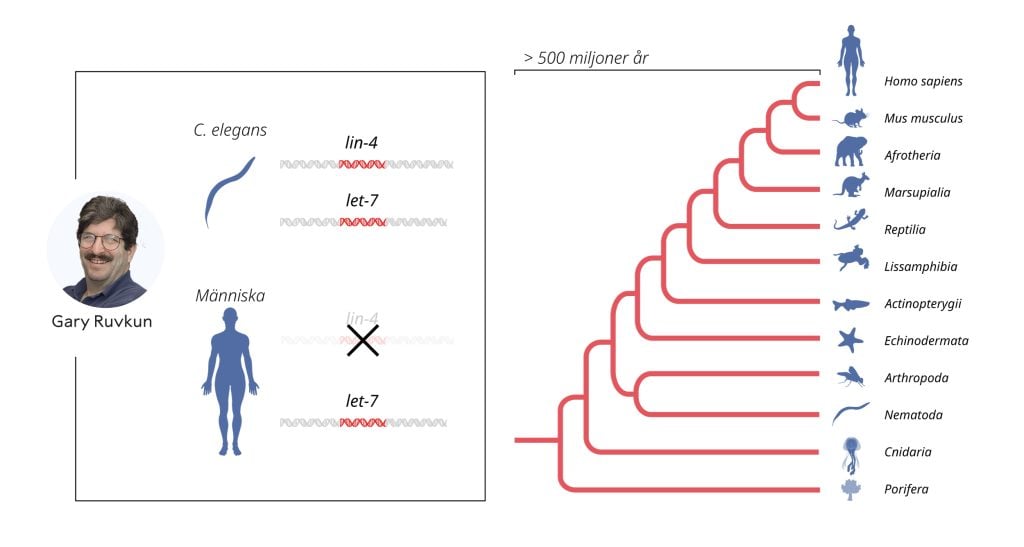
De nya fynden möttes initialt med nästan öronbedövande tystnad från forskarsamhället. Visserligen var resultaten intressanta men den ovanliga mekanismen för genreglering ansågs vara en egenhet för masken C. elegans, sannolikt utan relevans för människor och andra mer komplexa djur. Den bilden förändrades radikalt när Ruvkuns forskargrupp år 2000 publicerade upptäckten av ytterligare ett mikroRNA, kodat av let-7-genen. Till skillnad från lin-4 genen visade sig let-7-genen finnas hos människa och vara brett spridd i djurriket. Artikeln väckte ett stort intresse och under de följande åren identifierades många ytterligare mikroRNA gener. Idag vet vi att det finns mer än tusen olika gener för mikroRNA i människa och att genreglering via mikroRNA är universell hos flercelliga organismer.
Utöver kartläggningen av nya mikroRNA pågick samtidigt experiment hos flera forskargrupper som förklarade mekanismerna för hur mikroRNA framställs och hur de hittar till komplementära målsekvenser i mRNA. Bindning av mikroRNA leder till att mRNA bryts ner eller till att proteinproduktionen blockeras. Intressant nog visade det sig att ett mikroRNA kan reglera uttrycket av många olika gener och en gen kan regleras av flera olika mikroRNA. På så sätt koordineras och finjusteras hela nätverk av gener.
Det cellulära maskineri som används för att framställa funktionella mikroRNA utnyttjas också för att processa andra små RNA-molekyler i både växter och djur, bland annat för att skydda växter mot angripande virus. Andrew Z. Fire och Craig C. Mello, belönade med Nobelpriset 2006, beskrev processen RNA interferens, där specifika mRNA inaktiveras genom att dubbelsträngat RNA tillförs till celler.
Små RNA-molekyler med stor fysiologisk betydelse
Genreglering via mikroRNA, en mekanism först upptäckt av Ambros och Ruvkun, har funnits under hundratals miljoner år och möjliggjort utvecklingen av alltmer komplexa organismer. Från genetisk forskning vet vi nu att mogna celler och vävnader inte utvecklas normalt utan mikroRNA. Onormala mikroRNA-nivåer kan bidra till cancersjukdomar och mutationer i gener som kodar för mikroRNA orsakar bland annat medfödd hörselnedsättning, ögon- och skelettsjukdom hos människa. Det ovanliga men allvarliga DICER1-syndromet är kopplat till uppkomst av cancer i olika organ och vävnader. Det orsakas av mutationer i ett protein som behövs för produktion av mikroRNA i cellen.
Ambros och Ruvkuns banbrytande upptäckt i den lilla masken C. elegans var överraskande och avslöjade en ny dimension av genreglering, essentiell för alla komplexa livsformer.
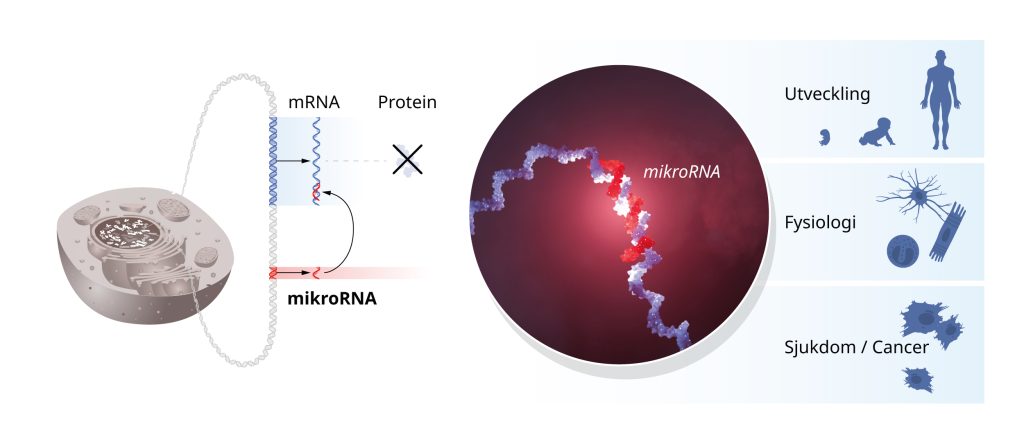
Den banbrytande upptäckten av mikroRNA var överraskande och avslöjade en helt ny dimension av genreglering.
Nyckelpublikationer
Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell. 1993;75(5):843-854. doi:10.1016/0092-8674(93)90529-y
Wightman B, Ha I, Ruvkun G. Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell. 1993;75(5):855-862. doi:10.1016/0092-8674(93)90530-4
Pasquinelli AE, Reinhart BJ, Slack F, Martindale MQ, Kurodak MI, Maller B, Hayward DC, Ball EE, Degnan B, Müller P, Spring J, Srinvasan A, Fishman M, Finnerty J, Corbo J, Levine M, Leahy P, Davidson E, Ruvkun G. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA. Nature. 2000;408(6808):86-89. doi:10.1038/35040556
Läs mer om årets pris
Victor Ambros föddes 1953 i Hanover, New Hampshire, USA. Han erhöll sin doktorsgrad vid Massachusetts Institute of Technology, Cambridge, MA 1979 där han också genomförde postdoktoral forskning under 1979-1985. Han inledde sin oberoende forskning vid Harvard University, Cambridge, MA, 1985 och var anställd som professor vid Dartmouth Medical School 1992 – 2007. Sedan 2008 är han anställd som professor i molekylär medicin vid UMass Chan Medical School in Worcester, MA och Silverman Professor of Natural Sciences.
Gary Ruvkun föddes 1952 i Berkeley, Kalifornien, USA. Han erhöll sin doktorsgrad från Harvard University 1982 och genomförde sedan postdoktoral forskning vid Massachusetts Institute of Technology, Cambridge, USA 1982-1985. Han inledde sin oberoende forskning vid Massachusetts General Hospital och Harvard Medical School 1985, där han är fortsatt verksam som Professor of Genetics.
Illustrationer: © Nobelkommittén för fysiologi eller medicin. Illustratör: Mattias Karlén
Nobelförsamlingen, som består av 50 professorer vid Karolinska Institutet, utser Nobelpristagare I fysiologi eller medicin. Utredningsarbetet genomförs av dess Nobelkommitté. Nobelpriset har sedan 1901 belönat de forskare som gjort de viktigaste upptäckterna till mänsklighetens nytta.
Nobelpriset® är Nobelstiftelsens registrerade varumärke
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 14 laureates' work and discoveries range from quantum tunnelling to promoting democratic rights.
See them all presented here.
