Pressmeddelande: Nobelpriset i kemi 1999
English
French
German
Swedish

12 oktober 1999
Kungl. Vetenskapsakademien har utdelat 1999 års Nobelpris i kemi till
Professor Ahmed H. Zewail, California Institute of Technology, Pasadena, USA
för att han har visat att man med snabb laserteknik kan se hur atomerna i en molekyl rör sig under en kemisk reaktion.
Vetenskapsakademiens motivering:
För hans studier av kemiska reaktioners övergångstillstånd med femtosekundspektroskopi.
Årets Nobelpristagare i kemi belönas för sina studier av fundamentala kemiska reaktioner på den tidsskala de verkligen sker. Ahmed H. Zewails insatser har inneburit en revolution inom kemi och angränsande vetenskaper, eftersom denna typ av undersökningar gör det möjligt att förstå och förutsäga viktiga processer.
Utvecklingen av femtokemi prisbelönas
Vad vore en TV-sänd fotbollsmatch utan “slow motion”, som efteråt avslöjar spelarnas och bollens rörelser då ett mål görs? Med kemiska reaktioner är det likadant. Kemisternas nyfikenhet att kunna följa kemiska reaktioner i minsta detalj har drivit fram allt mer avancerad teknik. Årets Nobelpristagare i kemi, Ahmed H. Zewail, har studerat atomerna och molekylerna i “slow motion” under en reaktion, och sett vad som egentligen händer då kemiska bindningar bryts och nya skapas.
Zewail har använt sig av en teknik som kan beskrivas som världens snabbaste kamera. Den går ut på att använda så korta laserblixtar att man är nere på den tidsskala där reaktionerna verkligen sker, nämligen femtosekunder (fs). En femtosekund är 10-15 sekunder, alltså 0,000000000000001 sekunder, vilket är lika kort i förhållande till en sekund som en sekund är i förhållande till 32 miljoner år. Detta område inom den fysikaliska kemin har fått namnet femtokemi.
Genom femtokemin kan man förstå varför vissa kemiska reaktioner äger rum men inte andra. Man kan också förklara varför reaktionernas hastighet och verkningsgrad beror på temperaturen. Runt om i världen studerar forskare förlopp med femtosekundspektroskopi i gaser, i vätskor och i fasta material, på ytor och i polymerer samt i biologiska system. Tillämpningarna spänner från hur katalysatorer fungerar och hur molekylära elektroniska komponenter ska konstrueras till de finaste mekanismerna i livsprocesserna och hur framtidens läkemedel skall framställas.
Hur fort går kemiska reaktioner?
Kemiska reaktioner kan, som vi alla vet, gå med mycket olika hastighet – jämför en rostande spik och exploderande dynamit! Gemensamt för de flesta reaktioner är dock att deras hastighet ökar när temperaturen höjs, d.v.s. när molekylrörelsen blir häftigare.
Sedan länge har forskarna därför antagit att en molekyl först behöver aktiveras, “sparkas” över en barriär, för att reagera. När två molekyler kolliderar händer vanligtvis ingenting, de bara studsar isär. Men, när temperaturen är tillräckligt hög blir kollisionen så häftig att de reagerar med varandra och nya molekyler bildas. När väl en molekyl fått en tillräckligt kraftig “temperaturspark” reagerar den oerhört snabbt varvid kemiska bindningar upplöses och nya bildas. Detta gäller också de reaktioner som verkar gå långsamt (t.ex. den rostande spiken). Skillnaden är bara att “temperatursparkarna” inträffar mer sällan i en långsam reaktion än en snabb.
Barriären bestäms av de krafter som håller atomerna samman i molekylen (de kemiska bindningarna), ungefär som den gravitationsbarriär en månraket från jorden måste övervinna innan den fångas in av månens kraftfält. Men molekylens väg upp över barriären och hur den egentligen ser ut när den just är på toppen av denna, det s.k. “övergångstillståndet”, visste man tills helt nyligen inte mycket om.
Hundra år av forskning
Svante Arrhenius (Nobelpristagare i kemi 1903), inspirerad av van’t Hoff (den förste Nobelpristagaren i kemi, 1901), beskrev för drygt hundra år sedan en enkel formel för reaktionshastigheten som funktion av temperaturen. Men denna avsåg många molekyler på en gång (makroskopiska system) och förhållandevis långa tider. Det var först på 1930-talet som H. Eyring och M. Polanyi formulerade en teori baserad på reaktioner i mikroskopiska system med enskilda molekyler. I teorin gjorde man antagandet att övergångstillståndet passerades mycket snabbt, på tidsskalan som gäller för molekylära vibrationer. Att man någonsin skulle kunna göra experiment på så korta tider kunde man inte drömma om.
Men detta var just vad Zewail målmedvetet gick in för. Mot slutet av 1980-talet gjorde han en serie experiment som kom att innebära födelsen av det forskningsområde som kallas femtokemi. Det går i princip ut på att med höghastighetskamera avbilda molekyler under själva förloppet av kemiska reaktioner och försöka fånga en bild av dem just i övergångstillståndet. Kameran byggde på nyutvecklad laserteknik med ljusblixtar på några tiotal femtosekunder. Den tid det tar för atomerna i en molekyl att utföra en vibration är i typfallet 10-100 fs. Att kemiska reaktioner bör ske på samma tidskala som när atomerna gungar fram och tillbaka i molekylerna, kan liknas vid att två trapetskonstnärer “reagerar” med varandra på samma tidsskala som deras trapetser svänger fram och tillbaka.
Vad såg man då när man successivt förbättrade tidsupplösningen? De första framstegen var upptäckten av ämnen som bildades på vägen mellan ursprungsämnen och slutprodukter, s.k. intermediärer. Det handlade till en början om jämförelsevis stabila molekyler eller molekylfragment. Varje förbättring av tidsupplösningen ledde till att nya länkar i en reaktionskedja, i form av alltmer kortlivade intermediärer, kunde fogas in i pusslet att förstå reaktionsmekanismen.
Den insats som Ahmed H. Zewail får Nobelpriset för innebär att vi kommit till vägs ände: snabbare än så sker inga kemiska reaktioner. Med femtosekundspektroskopin kan vi för första gången i “slow motion” observera vad som händer vid passagen över reaktionsbarriären och därmed också förstå den mekanistiska bakgrunden till Arrhenius formel för temperaturberoendet, liksom till de formler för vilka van’t Hoff fick sitt Nobelpris.
Femtokemin i praktiken
Femtosekundspektroskopi går till så att man blandar ursprungsämnena i form av molekylstrålar i en vakuumkammare. Sedan låter man en ultrasnabb laser skjuta in två pulser: först en stark s.k. pump-puls som träffar molekylen och exciterar den till ett högre energitillstånd, därefter en svagare prob-puls som har en våglängd inställd för att upptäcka ursprungsmolekylen eller en förändrad form av denna. Pump-pulsen är startsignal för reaktionen, medan prob-pulsen undersöker vad som händer. Genom att variera tidsintervallet mellan pump- och prob-puls kan man se hur fort ursprungsmolekylen omvandlas. De nya skepnader som molekylen antar då den exciterats – och kanske passerar ett eller flera övergångstillstånd – har spektra som kan användas som fingeravtryck. Tidsintervallen mellan pump- och prob-pulserna kan enkelt varieras genom att låta prob-pulsen ta en omväg med hjälp av speglar. Men det rör sig inte om långa omvägar: ljus går sträckan 0,03 mm på 100 fs!
För att bättre förstå vad som händer jämförs slutligen fingeravtrycken och tidsförloppen med teoretiska simuleringar baserade på resultat från kvantkemiska beräkningar (Nobelpris i kemi 1998) av spektra och energier för molekylerna i deras olika tillstånd.
De första experimenten
I sina första experiment studerade Zewail sönderfallet av jodcyanid: ICN –> I + CN. Forskarlaget lyckades observera ett övergångstillstånd just då I-C-bindningen var på väg att brytas; reaktionen sker på totalt 200 femtosekunder.
I ett annat viktigt experiment studerade Zewail sönderdelningen av natriumjodid (NaI):
NaI –> Na + I. Pump-pulsen exciterar jonparet Na+ I – som har jämviktsavståndet 2,8 Å mellan atomkärnorna (se Figur 1) till en aktiverad form [NaI]* som då får en kovalent bindning. Emellertid ändras egenskaperna då molekylen vibrerar; när atomkärnorna är i sina yttre vändlägen, 10-15 Å i sär, är elektronstrukturen jonisk, medan den alltså är kovalent vid korta avstånd. Vid en viss punkt under vibrationscykeln, just då atomkärnorna är 6,9 Å från varandra, är sannolikheten stor att molekylen antingen ramlar tillbaka till sitt grundtillstånd eller faller sönder i natrium- och jodatomer.
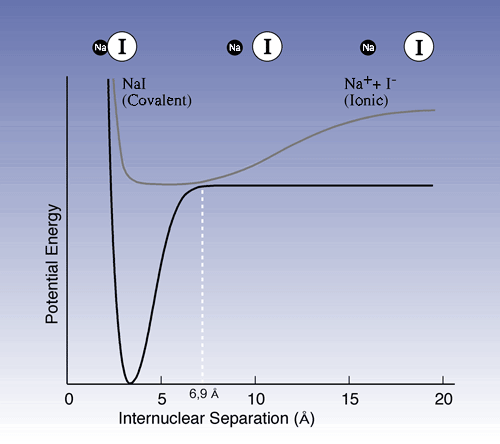 |
| Figur 1. Potentialenergikurvor som visar grundtillstånd och exciterat tillstånd för NaI. Den övre kurvan motsvarar molekylvibrationerna hos exciterad NaI. När avståndet mellan natriumkärnan och jodkärnan är kort dominerar den kovalenta bindningen, medan jonbindning dominerar vid längre avstånd. Vibrationerna kan liknas vid en kula som rullar fram och tillbaka i en skål. Vid passage av punkten 6,9 Å finns en chans att kulan ramlar ner till den undre kurvan. Där kan den hamna i gropen till vänster (tillbaka till grundtillståndet) eller fara ut åt höger (falla sönder i natrium- resp. jodatomer). |
Zewail studerade också reaktionen mellan väte och koldioxid: H + CO2 –> CO + OH en reaktion som sker i atmosfären och vid förbränning. Han visade att reaktionen går via ett relativt långlivat tillstånd HOCO (1000 fs).
En fråga som sysselsatt många kemister är varför vissa kemiska bindningar är mera reaktionsbenägna än andra och vad som händer om man har två likadana bindningar i en molekyl: kommer de att brytas samtidigt eller en i taget? För att få svar på denna typ av frågor studerade Zewail och hans medarbetare sönderfallet av molekylen tetrafluordijodmetan (C2I2F4 ) i tetrafluoretylen (C2F4 ) och två jodatomer (I):
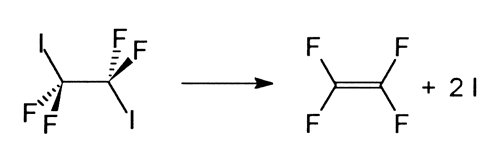
De upptäckte att de två C-I-bindningarna, trots att de är likvärdiga i ursprungsmolekylen, bryts en i taget.
Forskning är extra intressant då resultaten är oväntade. Zewail studerade den som man kan tycka enkla reaktionen mellan bensen, en ring med sex kolatomer (C6H6 ), och jod (I2 ), en molekyl bestående av två jodatomer. När de två molekylerna kommer tillräckligt nära varandra bildar de ett komplex. Laserblixten gör att en elektron skjuts från bensen in i jodmolekylen som då blir negativt laddad medan bensen blir positivt laddad. De negativa och positiva laddningarna gör att bensen och den närmaste jodatomen snabbt dras till varandra. Bindningen mellan de två jodatomerna sträcks ut när en av dem sugs in mot bensen, den andra atomen lossnar då och far i väg. Allt händer inom 750 fs. Zewail upptäckte emellertid att detta inte är det enda sättet som enskilda jodatomer kan bildas på: ibland ramlar elektronen tillbaka på bensen. Men då är det redan för sent för jodatomerna: som ett utsträckt gummiband som brister, bryts bindningen mellan de två atomerna och de flyger åt varsitt håll.
Explosion av forskning
En mycket studerad modellreaktion inom den organiska kemin är ringöppningen av cyklobutan för att få etylen, eller omvändningen, två etylenmolekyler som slår sig samman till cyklobutan. Reaktionen kan tänkas gå direkt över ett övergångstillstånd med en enkel aktiveringsbarriär såsom visas i schemat till vänster i Figur 2. Alternativt skulle den kunna ske genom en tvåstegsmekanism (schemat till höger), så att först en bindning bryts och tetrametylen bildas som mellanprodukt. Tetrametylen omvandlas i sin tur efter passage av ytterligare en aktiveringsbarriär till den slutliga produkten. Zewail och hans medarbetare kunde med femtosekundspektroskopi visa att mellanprodukten faktiskt bildades och hade en livslängd på 700 fs.
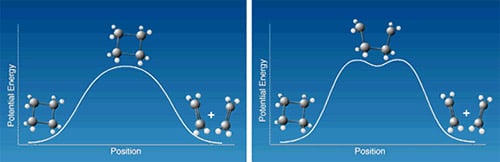 |
| Figur 2. Hur går egentligen reaktionen från molekylen cyklobutan till två etylenmolekyler till? Den vänstra figuren visar en modell för hur lägesenergin varierar om båda bindningarna sträcks och bryts samtidigt. Den högra figuren visar fallet där en bindning i taget bryts. |
En annan typ av reaktion som studerats med femtosekundteknik är ljusinducerad omvandling av en molekyl från en struktur till en annan, s.k. fotoisomerisering. Omvandlingen av molekylen stilben (som består bl.a. av två bensenringar) mellan formerna cis och trans observerades av Zewail och hans medarbetare.
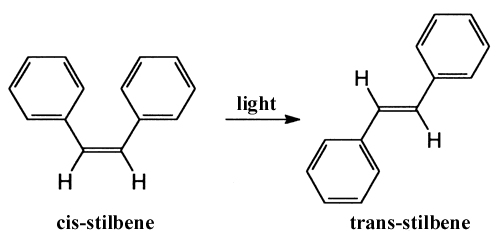
De drog slutsatsen att de två bensenringarna under processen vrider sig synkront i förhållande till varandra. Nyligen har ett liknande beteende också observerats för molekylen retinal som är färgämnet i rodopsin, pigmentet i stavarna i ögat. Det primära fotokemiska steget, då vi uppfattar ljus, är en cis-trans-omvandling kring en dubbelbindning i retinal. Med femtosekundspektroskopi har andra forskare funnit att processen går på 200 fs och att en viss vibration kvarstår hos reaktionsprodukten. Hastigheten hos reaktionen tyder på att energin från den absorberade fotonen inte först omfördelas utan direkt lokaliseras till den aktuella dubbelbindningen. Detta skulle förklara den höga verkningsgraden (70%) hos omvandlingen och därmed ögats goda mörkerseende.
Ett annat biologiskt viktigt exempel där femtokemi förklarat den effektiva energiomvandlingen, är hos de klorofyllmolekyler som fångar in ljuset i fotosyntesen.
Femtosekundstudier bedrivs intensivt runt om i världen, inte bara på molekylstrålar utan även på processer på ytor (t.ex. för att förstå och förbättra katalysatorer), i vätskor och lösningsmedel (för att förstå mekanismer för upplösning av och kemiska reaktioner mellan ämnen i lösning) samt i polymerer (för att t.ex. utveckla nya elektronikmaterial). Dessutom studeras en rad viktiga biologiska system. Kunskaper om kemiska reaktionsmekanismer är också viktig för att kunna styra reaktioner. Ofta åtföljs en önskad kemisk reaktion av en rad oavsedda, konkurrerande reaktioner som leder till en blandning av produkter och därmed behov av separation och rening. Om man kan kontrollera reaktionen genom att initiera reaktivitet i utvalda bindningar skulle man kunna undvika detta.
Femtokemin har fundamentalt förändrat vår syn på kemiska reaktioner. Från ett skeende beskrivet i form av relativt dunkla metaforer såsom “aktivering” och “övergångstillstånd”, kan vi idag se de individuella atomernas rörelser såsom vi föreställer oss dem. De är inte längre osynliga. Detta är orsaken till att forskningen inom femtokemin, som årets pristagare initierat, lett till en explosiv utveckling. Med världens snabbaste kamera till hands är det bara fantasin som sätter gräns för nya problem att angripa.
| Lästips |
| “Extended version in English” (pdf) by professor Bengt Nordén. |
| M.A. El-Sayed, I. Tanaka and Y. Molin “Ultrafast Processes in Chemistry and Photobiology” Blackwell Science 1995 306 pp, ISBN 0-86542-893-X. |
| S. Pedersen, J.L. Herek and A.H. Zewail “The Validity of the Diradical Hypothesis: Direct Femtosecond Studies of the Transition-State Structures”. Science Vol 266 (1994) 1359-1364. |
| A.H. Zewail “The Birth of Molecules” Scientific American December 1990 sid 40-46. |
| V.K. Jain “The World’s Fastest Camera” The World and I, October 1995 sid 156-163. |
| Nationalencyklopedin, Fysikalisk kemi (B. Nordén). |
| Nobel Symposium: Femtochemistry & Femtobiology: Ultrafast Reaction Dynamics at Atomic-Scale Resolution (Editor: V. Sundström) World Scientific, Singapore 1996. |
Ahmed H. Zewail föddes 1946 i Egypten, där han växte upp. Han började studera vid universitet i Alexandria och fortsatte sina studier i USA. 1974 disputerade han vid University of Pennsylvania. Efter två år vid University of California i Berkeley anställdes han vid California Institute of Technology, där han sedan 1990 innehar Linus Pauling-professuren i kemisk fysik. Zewail är egyptisk och amerikansk medborgare.
Professor Ahmed H. Zewail
California Institute of Technology
Arthur Amos Noyes Laboratory of Chemical Physics
Mail Code 127-72
Pasadena, California 91125
USA
Prissumman uppgår 1999 till SEK 7,9 miljoner.
Nobel Prizes and laureates
Six prizes were awarded for achievements that have conferred the greatest benefit to humankind. The 14 laureates' work and discoveries range from quantum tunnelling to promoting democratic rights.
See them all presented here.
